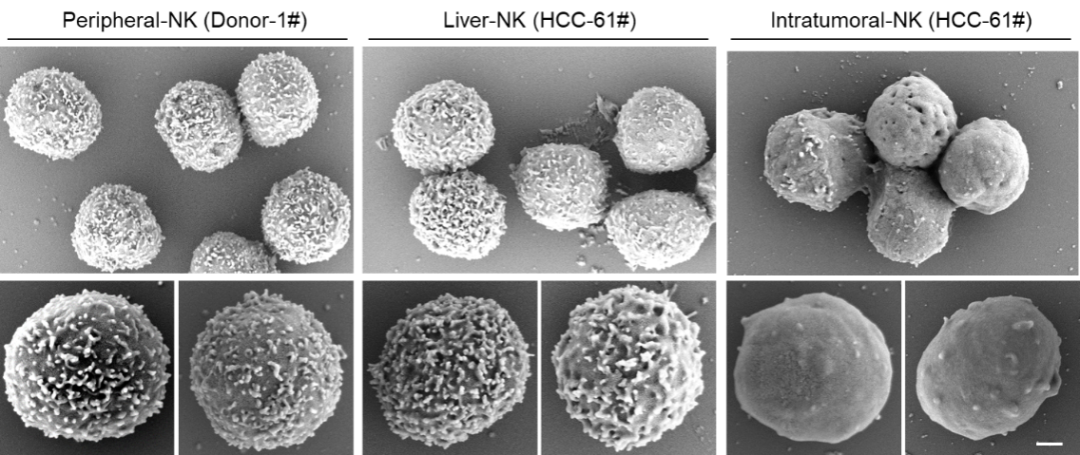
纤毛内转运(IFT)是由两个多亚基复合物组成的聚合物,IFT-A和IFT-B在纤毛中进行双向细胞内转运,这对纤毛生物发生和信号传导至关重要。IFT-A在膜蛋白的纤毛输入和逆行运输中起着至关重要的作用。然而,IFT-A的分子结构和IFT-A在体内IFT中的组装机制仍然难以捉摸。
2023年3月17日,上海交通大学雷鸣及武健共同通讯在Nature Communications发表题为“Structural insight into the intraflagellar transport complex IFT-A and its assembly in the anterograde IFT train”的研究论文,该研究报告了四膜虫的IFT-A复合物的冷冻电镜结构。
该研究发现IFT-A复合物呈现两种不同的细长和折叠状态。值得注意的是,与顺行IFT序列的原位冷冻电子断层扫描结构进行比较,揭示了apo IFT-A中柔性臂在并入顺行序列时的一系列调整。总之,本研究结果为IFT-A提供了复杂原子分辨率模型,并对顺行IFT序列的装配机理提供了有价值的见解。

纤毛是高度保守的细胞器,从细胞表面突出并发挥多种作用。纤毛功能障碍导致许多人类疾病,称为纤毛病,与视力障碍,肾功能障碍和男性不育有关。纤毛内运输(IFT)机制对于纤毛的组装和维护以及通过将货物送入和输送出纤毛来进行信号转导至关重要。
每个IFT系列都是两个大型配合物IFT-A和IFT-B的聚合物,分子量分别为0.8 MDa和1 MDa。IFT-B 复合物由 10 个亚基核心亚复合物 IFT-B1 和6 个亚基的外周亚复合物 IFT-B2 组成,在微管运动驱动蛋白的驱动下介导纤毛蛋白的顺行(向尖端)运输。IFT-A复合物由六个亚基(IFT144,IFT140,IFT122,IFT121,IFT139和IFT43)组成,介导由动力蛋白-1b驱动的逆行运输(向基部)和通过纤毛的各种膜蛋白的纤毛导入。
对莱茵衣藻的原位冷冻电子断层扫描(cryo-ET)研究表明,顺行序列密集地堆积着IFT-B作为位于IFT-A和轴突之间的骨干,而IFT-A位于纤毛膜正下方。到达纤毛尖端后,顺行序列被改造为完全不同的锯齿形逆行序列,协调多个事件,包括驱动蛋白-2的失活,动力蛋白-1b的活化和货物的释放。IFT-A缺陷或浓度降低导致纤毛短,逆行运输速度降低,纤毛尖端积聚IFT-B。IFT-A基因突变导致过多的纤毛病,包括骨骼,肾脏和眼睛相关疾病。缺乏高分辨率的IFT-A结构极大地阻碍了研究者对IFT-A在IFT序列中的组装机制以及纤毛运输和纤毛病的分子基础的理解。
最近,一些研究报告了高分辨率冷冻电子显微镜(cryo-EM)IFT-A结构以及顺行IFT序列的20.7-Å原位冷冻电子断层扫描模型。该研究从四膜虫中纯化了IFT-A复合物,并在3.6至8.8 Å的分辨率范围内确定了IFT-A复合物及其子组件的冷冻电镜结构。
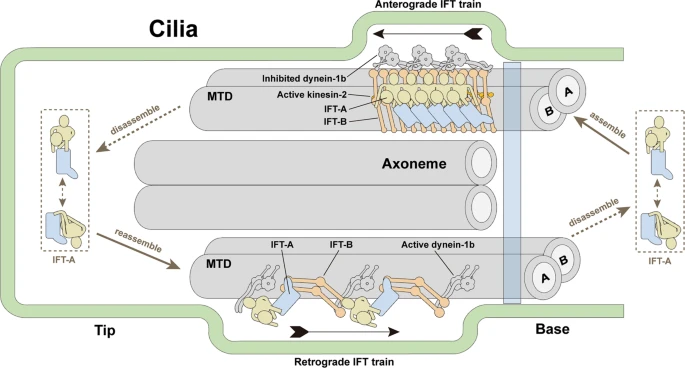
IFT-A循环示意图(图源自Nature Communications )
对这些结构的分析表明,apo IFT-A复合物由两个刚性结构模块组成,即头部和底座模块,并且在溶液中呈现两种不同的拉长和折叠状态,后者在最近的IFT-A结构研究中未被发现。此外,该研究发现IFT-A通过对apo IFT-A中柔性臂的一系列调整被纳入顺行IFT序列。总之,研究结果极大地扩展了对IFT序列组装机制的理解,并为人类疾病相关IFT-A变异的发病机制提供了结构见解。