许多动物利用地球磁场(也称为地磁场)来导航。磁敏的有利机制涉及蓝光激活的电子转移反应黄素腺嘌呤二核苷酸(FAD)和光感受器蛋白隐花色素(CRY)内的色氨酸残基链。由此产生的自由基对的自旋状态,以及活性状态下CRY的浓度,都受到地磁场的影响。然而,规范的以CRY为中心的激进对机制并不能解释许多生理和行为观察。
2023年2月22日,英国曼彻斯特大学Richard A. Baines及莱斯特大学Ezio Rosato共同通讯在Nature在线发表题为“Essential elements of radical pair magnetosensitivity in Drosophila”的研究论文,该研究使用电生理学和行为分析,在单个神经元和生物体水平上分析磁场反应。该研究发现,果蝇(Drosophila melanogaster) CRY中缺少典型FAD结合域和色氨酸链的52个C端氨基酸残基足以促进磁接收。
该研究还表明,增加细胞内FAD增强了蓝光诱导和磁场依赖的C端介导的活性效应。高水平的FAD本身就足以引起蓝光神经元的敏感性,特别是在磁场的共同存在下,这种反应的增强。这些结果揭示了果蝇中主要磁感受器的基本成分,为非典型(即非CRY依赖的)自由基对可以引起细胞中的磁场反应提供了强有力的证据。

长期以来,生物学界一直对物种远距离航行的能力很感兴趣。支持这些迁移的几个环境线索之一是地磁场(geoMF)。此外,至少在实验室条件下,其他几种行为对磁场(MFs)的反应是可靠的,这表明对磁场的感知和反应能力并不局限于迁徙动物。然而,主要磁感受器的身份,它们所报道的光依赖性的机制以及磁信号是如何转导的仍然不清楚。一种比较受欢迎的模型假设存在光诱导的电子转移反应,由此形成了自由基对(RPs),其自旋态对小到geoMF(约50 μT)的MF敏感。这种所谓的RP机制(RPM)通常需要黄蛋白CRY,其最广为人知的作用是在果蝇中作为昼夜蓝光(BL)光感受器,以及在哺乳动物的昼夜生物钟中作为光不敏感转录调节因子。
由CRY结合的FAD对BL的吸收沿色氨酸(Trp)残基的保守链启动电子转移级联。在果蝇中,这形成了自旋相关的RP,包括光还原的FAD (FADº−)和末端氧化的色氨酸(TrpHº+)。RP的自旋状态最初极化为单线态(S,反平行自旋),然后在S和三线态(T,平行自旋)之间快速振荡。短暂地(即在系统松弛到平衡之前),这种相互转换可以对MF敏感,进而通过构像变化导致果蝇CRY (DmCRY)生物活性的下游修饰。在其激活状态下,DmCRY的 C端约20个残基(CTT)的尾部暴露出来,使其能够与信号伙伴相互作用,包括含有PDZ结构域的蛋白质。
尽管有足够的证据表明,对于依赖于光的磁敏性来说,CRY是必要和充分的,但也有一些研究支持这种机制的例外。其中最值得注意的一项研究是在果蝇中进行的昼夜行为学实验,该实验表明,通过DmCRY融合到GFP (GFP-CT)的52个C端残基(CT)表达,可以在DmCRY缺失的成年果蝇中恢复DmCRY依赖的光和磁敏感性。此外,由于DmCRY的CTT缺失,DmCRYΔ似乎对MF基本不敏感,尽管BL敏感性保持不变。
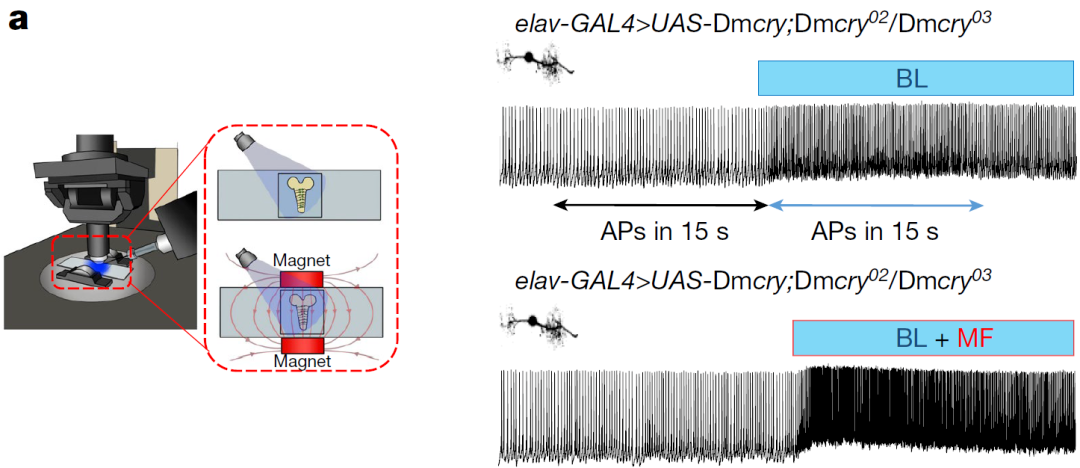
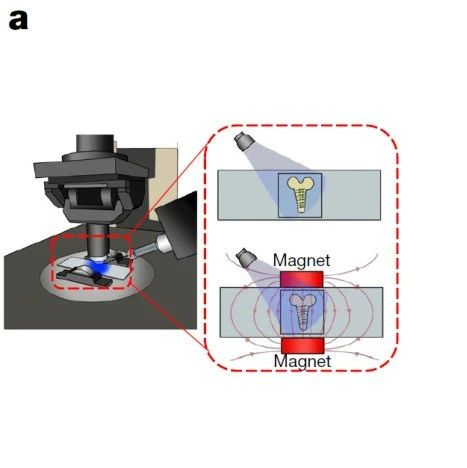
Luc–CT 足以支持磁敏(图源自Nature )
果蝇CRY CT既缺乏FAD结合口袋,也缺乏四个Trp残基链(Trp394、Trp342、Trp397和Trp420),而这些残基被认为是规范RPM所必需的。此外,突变这些Trp残基,包括W420F和W342F,充其量只能减弱,但不能消除DmCRY的磁性功能。这些结果与目前对RPM的理解不一致,并对受体中磁敏RP的身份提出了质疑。FADº−和TrpHº+之间的RP的建议替代方案包括FADº−/FADHº和O2º−之间的RP或另一个(未知的,Zº)基的形成。这些非常规RPs是否有助于磁接收,甚至是否代表主要传感器,这是一个有争议的问题。
该研究报道了一种新的转基因编码DmCRY-CT融合荧光素酶(以下简称Luc–CT )的表达,该基因缺乏典型的FAD结合口袋和Trp链,因此不能支持光诱导的分子内电子转移。然而,Luc-CT足以在全生物昼夜行为学实验和模型神经元(幼虫aCC运动神经元)的电生理活动中产生BL-和MF依赖表型的变化。该研究发现,增加细胞内游离FAD浓度增强了Luc–CT的MF反应,在没有Luc–CT的情况下,仅高水平的这种黄素就可以支持MF反应。最后,该研究通过突变分析证实,DmCRY的CTT完整性与其促进对MF敏感性的能力相关。总的来说,该研究结果表明“传感”和“转导”MF是不同的特性,不需要由同一分子来实现。