通过对盐税的征收变相地征收人头税,从一个侧面体现出盐在每个人生活中的不可或缺。不过,到了现在,人们则更多关注高盐饮食将会对健康造成的不良影响。
虽然难以在研究中将盐的摄入量与其他饮食生活方式完全剥离,但我们确实知道,高盐饮食会诱发高血压、骨质疏松、胃炎、糖尿病、哮喘等疾病。此外还已经证实,高盐饮食会使免疫细胞由平衡状态转向促炎状态。
在我们的免疫系统中,调节性T细胞(Regulatory cells,Tregs)担任着“监督者”的职责,具有免疫抑制作用,通过抑制或下调其他T细胞的诱导和增殖,来确保免疫反应以可控的方式发生。当Treg细胞功能失调,将出现种种自身免疫性疾病,如多发性硬化症(MS)、系统性红斑狼疮(SLE)、类风湿性关节炎(RA)或1型糖尿病(T1D)和慢性感染等。
有意思的是,高盐诱导下的Treg细胞表现出与常在自身免疫性疾病患者身上观察到的功能失调的Treg细胞有着极高的相似性。这暗示过量的盐摄入可能导致整体免疫失衡,可能是导致疾病的风险因素之一。
近年来,免疫代谢方面的研究表明,许多免疫反应是通过细胞代谢的变化来控制的。而对于Treg细胞来说,线粒体呼吸对其功能的维持至关重要。在多发性硬化症患者身上,也发现分离出的Treg细胞的最大呼吸水平降低,线粒体基因失调,线粒体功能缺陷。另一方面,已有研究阐明,在单核细胞和巨噬细胞中,钠离子通过Na+/Ca2+交换器(NCLX)进入线粒体,随后抑制位于线粒体内膜上的电子传输链(electron transport chain,ETC)并减弱ATP的产生。
那么,这一机制是否也适用于Treg细胞呢?
为此,Max Delbrück分子医学中心和实验与临床研究中心的Dominik Müller授团队围绕Treg细胞在高盐环境下展现出的表型变化及背后机制进行了研究,相关结果以“Sodium perturbs mitochondrial respiration and induces dysfunctional Tregs”为题发表于Cell Metabolism。

图1 研究成果(图源:[1])
研究发现:
01 高盐诱导的Treg细胞表型特征类似于功能失调的自身免疫性Treg细胞
研究人员在体外模拟了高盐饮食后或炎症期间在间质组织中发现的Na+浓度增加现象,结果发现Treg细胞对其他免疫细胞的抑制能力减弱,表达细胞因子IFN-γ,增殖的水平也更高,与自身免疫疾病中观察到的功能失调的Treg细胞特征相似,RNA测序的结果进一步证实了这一点,即Treg细胞发生了代谢重编程。
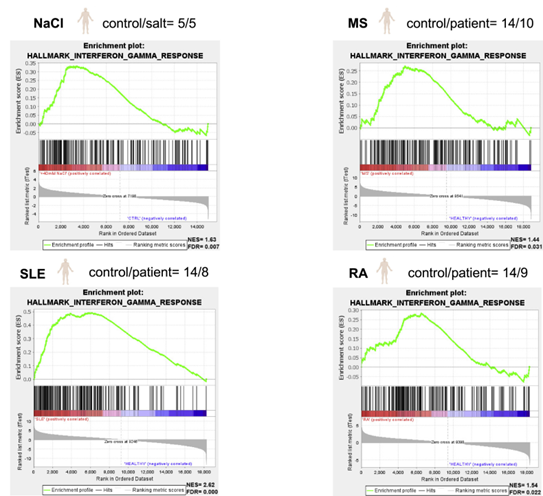
图2 高盐诱导的Treg细胞表型和功能变化与人类自身免疫性Treg细胞非常相似(图源:[1])
02 高盐会扰乱Treg细胞的线粒体呼吸
高盐条件下,丙酮酸代谢和三羧酸(TCA)循环的关键节点下调,尿素循环上调。TCA循环中,琥珀酸脱氢酶(Succinate dehydrogenase,SDH)受到抑制,导致琥珀酸累积,通过电子传输链的电子减少,细胞氧化磷酸化(oxidative phosphorylation,OXPHOS)的能力下调。氧化磷酸化是Treg细胞的主要代谢方式。
高盐条件下,Treg细胞的最大呼吸显著降低,ATP的产生显著减少,线粒体膜电位崩溃。RNA-seq分析显示,高盐处理与细胞呼吸抑制剂抗霉素A处理呈现出高度重叠的基因特征。对小鼠基因敲除使线粒体ETC复合物III消融,其基因表达模式和功能失调表型同样与高盐处理高度类似。
进一步的scRNA-seq分析表明,高盐或抗霉素A处理将使得FOXP3基因快速下调,FOXP3是Treg细胞发育和功能的关键转录因子之一,因此这可能是Treg细胞功能丧失的原因。
03 高盐会扰乱Treg细胞的线粒体呼吸
针对健康志愿者每日盐摄入量分析Treg细胞表型,发现高盐组(>7克/天)Treg细胞中IL-10的表达显著降低,且与盐摄入呈负相关;FOXP3减少,IFN-γ表达增加。
小鼠实验表明,Treg细胞的过继转移可以改善实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis,EAE),这可能是由于Treg细胞产生的IL-10。但高盐预处理的Treg细胞无法改善EAE的进展,疾病评分显著提高。
在异种移植物抗宿主病(xenogeneic graft vs. host disease,xGvHD)模型中,对小鼠移植了人效应T细胞和不同条件处理的人Treg细胞,结果表明,仅仅使用高盐或抗霉素A预孵育6小时,人Treg细胞就出现功能丧失,无法预防小鼠的xGvHD。这表明,即使线粒体呼吸被高盐短暂扰动,也可能导致人/鼠体内Treg细胞功能的长期破坏。

图3 xGvHD模型中,仅未处理Treg细胞能预防xGvHD(图源:[1])
03 高盐诱导的线粒体功能障碍取决于NCLX,抑制NCLX可恢复Treg细胞功能
检查高盐对电子传输链的影响,发现在在无细胞和无线粒体的测定中,Na+使复合物II的功能降低了近50%。NaCl浓度增加时,完整纯化线粒体中复合物II/III的功能抑制程度依赖于NaCl的剂量。表明,高盐在ETC复合物II/III水平上诱导Treg细胞的线粒体呼吸紊乱。
低氧条件下,Na+通过NCLX流入线粒体,考虑到Na+对复合物II/III活性的直接影响,研究人员测试了NCLX抑制剂能否逆转这种影响。结果表明,NCLX抑制剂能够在体内恢复受高盐扰动的Treg细胞功能,证明了NCLX在Treg细胞免疫代谢紊乱和功能障碍中的关键作用。
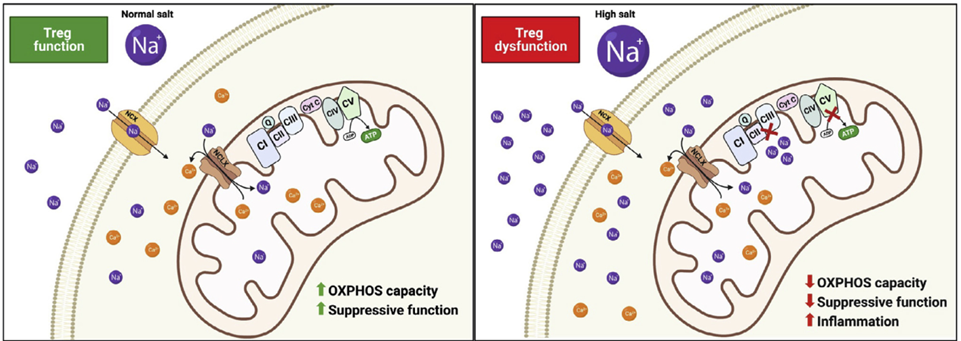
图4 NCLX控制Treg细胞免疫代谢和功能的示意图(图源:[1])
研究的通讯作者、哈塞尔特大学VIB转化免疫调节实验室的Markus Kleinewietfeld教授表示,了解导致自身免疫性Treg细胞功能障碍的因素和潜在分子机制不仅对于该领域十分重要,“由于Treg细胞也在癌症或心血管疾病等疾病中发挥作用,进一步探索这种钠引起的效应还将有可能为改变不同类型疾病中的Treg细胞功能提供新策略。”但同样,更详细的分子机制及其与疾病之间的关系需要进一步的研究。
题图来源:curie.bio,仅用于学术交流。
参考资料:
[1]Côrte-Real BF, Hamad I, Arroyo Hornero R, et al. Sodium perturbs mitochondrial respiration and induces dysfunctional Tregs. Cell Metab. 2023 Feb 7;35(2):299-315.e8. doi: 10.1016/j.cmet.2023.01.009. PMID: 36754020.
[2]https://www.mdc-berlin.de/news/press/salt-cuts-energy-supply-immune-regulators