导语:孕妇能否接种新冠病毒疫苗?这个问题自疫情之初便一直困扰着所有人,也一直是大众争论的热点。对此,世界卫生组织(WHO)和美国疾控中心(CDC)给出了不同建议。
美国疾控中心免疫接种咨询委员会(Advisory Committee on Immunization Practices,ACIP)表示,孕妇可接种新冠疫苗,但接种前需咨询医生。这一建议将疫苗接种的决定权移交到孕妇手中。而世卫组织则建议,除非孕妇本身患有慢性病,或工作中接触新冠病毒的风险较高,否则不建议接种新冠疫苗,此建议对辉瑞疫苗和莫德纳疫苗的mRNA疫苗均适用。为何两大权威组织意见相左?主要是因为孕妇群体的特殊性,一直被排斥在临床试验之外,导致缺乏必要的数据支撑。
在我国,目前缺乏针对孕期接种新冠肺炎疫苗的相关数据。考虑到孕期女性的特殊生理、免疫状态,我国《新冠病毒疫苗接种技术指南(第一版)》将孕期列为新冠肺炎疫苗的接种禁忌,因此怀孕女性不可以打新冠肺炎疫苗。那么,国外那些接种疫苗的孕妇现状如何?接种疫苗是否安全?接种疫苗能给孕产妇和宝宝带来什么益处?下面请跟随多项JAMA研究一探究竟。
JAMA研究一:孕期接种新冠疫苗安全无虞
此前的研究报道表明,孕妇罹患新冠会导致严重的后遗症。在此背景下,美国CDC、美国妇产科学院及欧洲卫生当局都建议孕妇积极接种新冠疫苗。但由于担心接种疫苗的安全性,孕妇可能会对怀孕期间接种疫苗犹豫不决。
其实早在今年1月,一项发布在Nature Medicine的研究论文表示,接种新冠疫苗对孕妇具有保护作用[1]。随后,国外研究孕妇接种疫苗数据的相关研究纷纷涌现。
3月24日,一项发表在顶级医学期刊Journal of the American Medical Association(JAMA)上,题为“Association of SARS-CoV-2 Vaccination During Pregnancy With Pregnancy Outcomes”的回顾性队列研究表明,妊娠期接种新冠疫苗与妊娠不良结局风险增加未呈现显著相关性,即接种疫苗并不是导致不良妊娠结果的原因。

图1 研究成果(图源:[2])
该研究自2021年1月1日至2022年1月12日期间,共招募了157521名来自瑞典和挪威在22孕周后结束单胎妊娠的产妇,其中103409位来自瑞典,5411位来自挪威。研究人员从国家疫苗接种登记处收集了mRNA疫苗BNT162b2(Pfizer-BioNTech)、mRNA-1273(Moderna)及病毒载体疫苗AZD1222(AstraZeneca)的接种数据。
在纳入研究的157521名产妇中,共有28506名产妇接种了新冠疫苗,占总人数18%,其中:
■ 接种BNT162b2疫苗占总人数12.9%,接种mRNA-1273为4.8%,AZD1222为0.3%;
■ 在孕早期(<84 84-195="">195 孕天)接种疫苗的分别有0.7%、8.3%和9.1%;
研究人员以怀孕天数作为时间指标,使用Cox回归模型评估接种人早产和死产的风险,疫苗接种作为时间相关的暴露变量。使用逻辑回归评估小于胎龄儿、低Apgar评分和新生儿护理入院的风险,发现接种新冠疫苗与早产、死产等不良妊娠结果的风险增加无显著相关性。具体如下:
■ 在所有新生儿中,8.4%为小于胎龄儿,1.6%的Apgar评分较低(<7),8.5%接受过新生儿护理。对于那些在怀孕期间接种母体疫苗的小于胎龄儿,其风险未呈现统计学上的增加;<>br
■ 在研究期间,仅0.2%的分娩以死产告终。2个暴露组的死产累积发生率曲线如下图所示(图2)。调整后的分析表明,在怀孕期间接种疫苗死产风险未呈现统计学上的增加;
注:小于胎龄儿又称宫内生长迟缓儿或小样儿,是指出生体重低于同胎龄平均体重的第10百分位数,或低于同胎龄平均体重的2个标准差的新生儿。这部分新生儿在围产期有极高的风险。
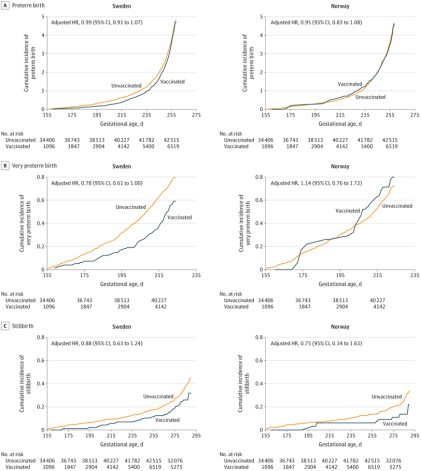
图2 对比接种疫苗与否,早产、极早产和死产风险的累积发生率曲线(图源:[2])
在瑞典和挪威进行的这项基于人群的研究中,与怀孕期间未接种新冠疫苗相比,怀孕期间接种新冠疫苗与不良妊娠结局风险增加未呈现显著相关性。这一研究给那些担心在孕期接种疫苗不安全的人群吃了一颗定心丸。
JAMA研究二:孕期接种疫苗与围产期不良结果无关
上述研究论证了怀孕期间接种疫苗的安全性,那么孕期接种疫苗是否与围产期不良结果相关?针对这一疑虑,JAMA也发表了相关研究。
3月24日,一项发表在JAMA上,题为“Association of COVID-19 Vaccination in Pregnancy With Adverse Peripartum Outcomes”的回顾性队列研究旨在评估怀孕期间接种新冠疫苗与分娩前、分娩期间或分娩后发生的孕产妇和新生儿围产期结局之间的关联。研究结果表明,怀孕期间接种新冠疫苗与围产期不良结局风险的增加未呈现显著相关性。

图3 研究成果(图源:[3])
注:围产期是指怀孕28周到产后一周这一段分娩前后的重要时期,做好围产期的保健,可以明显的降低婴儿和母亲的发病率和死亡率。
此项回顾性队列研究使用加拿大安大略登记处常规收集的数据,招募了来自全省的97590人,其中有22660人在怀孕期间至少接种了1剂新冠疫苗,占比23%,剩余未接种过疫苗的为对照组。在接种疫苗人群中,79.9%接种了第1针剂的BNT162b2,19.9%接种了mRNA-1273,不到1%接受了其他疫苗。围产期数据则是从全省250多家医院、分娩中心、助产士实践小组和产前筛查实验室收集而来。
研究人员使用线性和泊松回归用于生成调整后的风险差异 (aRDs) 和风险比 (aRRs),比较怀孕期间接种疫苗的人群和没有接种疫苗记录人群的累积结局发生率,重点评估围产期易出现的产后出血、绒毛膜羊膜炎、紧急剖宫产、入住新生儿重症监护室和新生儿评分Apgar低(<7)等问题,发现妊娠后接种疫苗和未接种疫苗相比,其产后出血、绒毛膜羊膜炎、剖宫产的风险增加无显著相关性(图4)。
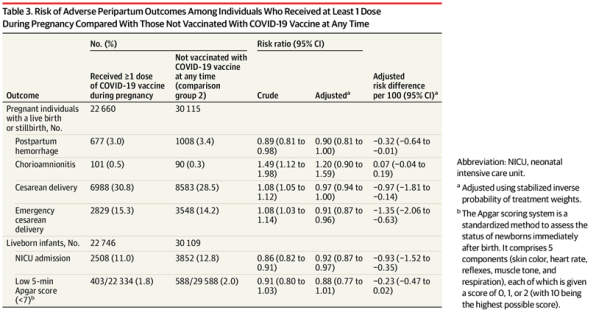
图4 妊娠期间接种疫苗与未接种群体的在围产期的不良结局风险差异(图源:[3])
进一步分析接种人群和非接种人群特点,研究人员发现:
■ 在怀孕期间接种疫苗的人不太可能小于30岁,更有可能居住在收入较高的社区和具备较低的物质剥夺(一种评估社会资源缺失的指标),不太可能生活在农村地区;
■ 与从未接种疫苗的人相比,怀孕期间接种疫苗的人更有可能是初次生育的,怀孕期间不太可能吸烟;
此项人群队列研究发现,妊娠期间接种新冠疫苗与围产期不良结局风险增加没有显著相关性。这一研究更进一步论证了接种疫苗对妊娠未产生不良影响,而接种疫苗则能为孕妇提供更多保护,使她们免受新冠后遗症的伤害。
JAMA研究三:孕期接种新冠疫苗宝宝也受益
上述研究论证了孕期接种疫苗的安全性,那么孕期接种疫苗对即将出生的宝宝有益处吗?针对这一点,JAMA也发表过相关研究。
2月7日,JAMA以研究快报(Research Letter)的形式在线发表了由美国麻省总医院、布里格姆妇女医院等团队联合完成的一项研究,该研究表示与未接种疫苗、感染新冠病毒的母亲所生的婴儿相比,怀孕期间接种疫苗的孕妇所生婴儿的抗体水平更持久。这一研究或能解答“母亲在接种疫苗后获得的抗体能在婴儿体内持续多久”这个问题。

图5 研究成果(图源:[4])
此前研究发现,妊娠期接种新冠疫苗可在母体中产生功能性抗刺突蛋白(anti-S) IgG抗体,这种抗体在孕妇分娩时的脐带血中可检测到,能保护新生儿和婴儿免受新冠病毒感染。另外,脐带血中的抗刺突蛋白IgG抗体滴度与母亲体内的滴度相关,在妊娠20至32周这一窗口期,抗体经胎盘转移效果最好。那么疫苗诱导的母体抗刺突蛋白IgG在婴儿血液中的持久性如何?母亲在妊娠期接种疫苗带来的抗体和自然感染后带来的抗体,对婴儿来说又有何不同影响?此项研究或能进一步解答。
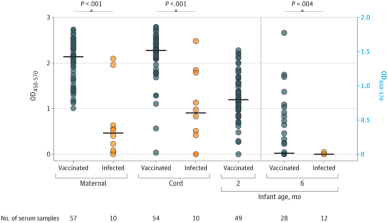
图6 母体接种疫苗后婴儿抗体的持续存在(图源:[4])
注:黑线代表每组在每个时间点的中位数。
研究人员招募妊娠20周至32周时,接种了两剂mRNA疫苗的或感染过新冠病毒的孕妇作为研究对象,并将她们分娩的孩子纳入后期随访研究中。最终纳入了77名接种疫苗的孕妇和12名妊娠期有症状的新冠感染患者。在分娩2个月时,研究人员采集了49例接种疫苗母亲的婴儿的毛细管血清样本;在6个月时,采集了28名接种疫苗母亲的婴儿(平均出生后170天)和12名感染过病毒母亲的婴儿(平均出生后207天)的血清样本。检测后发现:
■ 接种疫苗的母亲及其脐带血在分娩时的滴度或抗体水平高于那些感染新冠的研究参与者。2个月后,接种疫苗的母亲所生的婴儿中,可检测到98%(48/49)的保护性免疫球蛋白G (IgG)水平;
■ 对于那些母亲接种疫苗的婴儿,其抗体持久性也显著高于感染组。6个月时,研究人员观察了28母亲曾接种疫苗的婴儿,发现57%(16/28)仍然含有可检测到的IgG。相比之下,这一比例在感染过新冠病毒的母亲所生的婴儿中仅8%(1/12);
麻省总医院的母胎医学专家、该研究的通讯作者Andrea Edlow表示,“虽然还不清楚需要多高的滴度才能完全保护婴儿不受新冠病毒感染,但我们已知道抗刺突蛋白IgG水平与保护婴儿不感染严重疾病相关。抗体反应的持久性表明,接种疫苗不仅为母亲提供持久的保护,而且大多数婴儿体内的抗体至少能持续到6个月。”
孕妇患新冠肺炎严重并发症的风险较高,因此了解婴儿中来自母亲的抗体水平的持久性则显得尤为重要。在婴儿新冠疫苗开发滞后的背景下,这一研究结果或能激励更多国外孕妇积极接种疫苗,增强婴儿对新冠病毒的抵抗力,这对于当下对抗奥密克戎新变异体显得意义重大。(注:以上三项研究中的疫苗接种多为mRNA疫苗,在解读研究结果时应考虑此点。)
题图来源:GETTY IMAGES,仅用于学术交流。
撰文|露娜
排版|木子久
参考资料:
[1]Stock SJ, Carruthers J, Calvert C, et al. SARS-CoV-2 infection and COVID-19 vaccination rates in pregnant women in Scotland. Nat Med. 2022 Mar;28(3):504-512. doi: 10.1038/s41591-021-01666-2. Epub 2022 Jan 13. Erratum in: Nat Med. 2022 Feb 4;: PMID: 35027756; PMCID: PMC8938271.
[2]Magnus MC, Örtqvist AK, Dahlqwist E, et al. Association of SARS-CoV-2 Vaccination During Pregnancy With Pregnancy Outcomes. JAMA. 2022 Apr 19;327(15):1469-1477. doi: 10.1001/jama.2022.3271. PMID: 35323851; PMCID: PMC8949721.
[3]Fell DB, Dhinsa T, Alton GD, et al. Association of COVID-19 Vaccination in Pregnancy With Adverse Peripartum Outcomes. JAMA. 2022 Apr 19;327(15):1478-1487. doi: 10.1001/jama.2022.4255. PMID: 35323842; PMCID: PMC8949767.
[4]Shook LL, Atyeo CG, Yonker LM, et al. Durability of Anti-Spike Antibodies in Infants After Maternal COVID-19 Vaccination or Natural Infection. JAMA. 2022 Mar 15;327(11):1087-1089. doi: 10.1001/jama.2022.1206. PMID: 35129576; PMCID: PMC8822441.







