导语:人的一生看似漫长,但三分之一的时间都在睡觉。其实,不止人类,自然界中的万物几乎都有规律性睡眠现象。睡眠现象背后的深层次原因,不仅你我好奇,科学家们也很好奇。生命科学的研究,归根结底都绕不开基因,这条研究路径同样适用于解答睡眠与基因的关系。
近期研究发现,人类需要睡眠或许是为了修复时时刻刻都在断裂的DNA。熬夜行为势必会打乱正常睡眠周期,影响睡眠时长,由此留给DNA修复的时间大幅减少,而DNA断裂却不会止步不前。
睡眠期间的DNA修复是如何调控的?
2021年11月18日,以色列巴伊兰大学生命科学学院和多学科脑研究中心科研团队在Molecular Cell发表了一篇题为“Parp1 promotes sleep, which enhances DNA repair in neurons”的研究(图1)[1]。此项研究发现DNA损伤是睡眠的稳态驱动因素,而Parp1通路感知细胞压力并促进睡眠和DNA修复活动。

图1 研究成果(图源:[1])
此项研究选用斑马鱼和小鼠为研究对象,通过紫外线辐射、药物干预和光遗传学处理,诱导DNA损伤,并在单个神经元水平上分析睡眠在恢复核稳态中的作用。斑马鱼是科研常用的成熟睡眠模型,因为斑马鱼大脑透明、简单且具有与人类相似的夜间睡眠模式,其大脑的结构和功能,以及DNA损伤和修复系统,在哺乳动物中是保守的(图2)。研究结果如下:
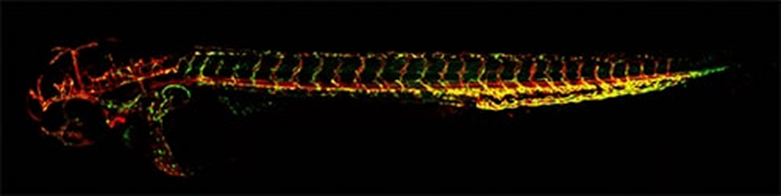
图2 透明斑马鱼(图源:牛津大学)
1 累积的DNA损伤是斑马鱼睡眠的原因
随着DNA损伤的增加,斑马鱼对睡眠的需求也显著增加。睡眠会增加神经元中Rad52和Ku80修复蛋白的聚集,从而使斑马鱼DNA损伤水平正常化。神经元DNA损伤水平与总睡眠时间之间存在很强的正相关(R=0.76),表明DNA损伤的数量可以预测修复所需的总睡眠时间。斑马鱼睡眠时神经细胞中的染色体移动速度是清醒时的两倍,这种运动使得受损的DNA能够自我重组和修复,如果斑马鱼的睡眠时间不足6小时,DNA损伤就并没有充分减少,在白天也会继续睡觉。
2 Parp1调控清除神经元DNA损伤
Parp1是DNA损伤修复系统的一部分,对单链和双链DNA断裂有反应,是一种DNA损伤检测器,可用于DNA修复反应。Parp1在DNA断裂位点的聚集,在斑马鱼清醒时增加,睡眠时减少。Parp1可以感知到清醒时不断增加的DNA损伤,如果损伤达到某个阈值,它就向大脑发出信号,促进睡眠和DNA修复,从而减少DNA断裂。相反,如果抑制了Parp1,斑马鱼就不会去睡觉,DNA修复也不会发生。即使在强烈的睡眠压力下,Parp1敲除消除了DNA损伤诱导的睡眠、染色体动力学和修复(图3)。
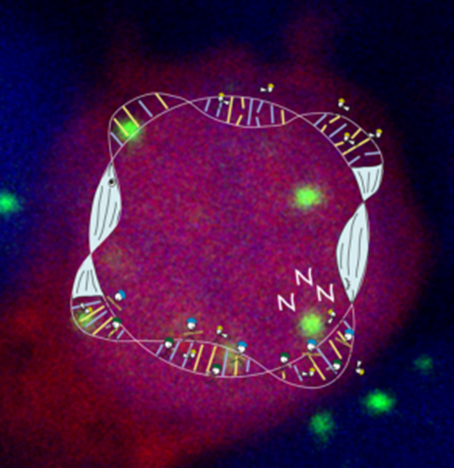
图3 Parp1调控清除神经元DNA损伤的过程(图源:[1])
注:作为细胞“天线”,Parp1蛋白(黄色)感知和标记细胞中的DNA断裂,驱动睡眠,并招募修复系统(绿色和蓝色)。在睡眠期间,DNA修复系统会修复受损DNA。
3 Parp1的敲除影响睡眠质量
小鼠体内Parp1的敲除降低了非快速眼动睡眠的持续时间和质量。Parp1对睡眠深度的影响,超出其对睡眠持续时间的影响
Lior Appelbaum博士表示:“一般而言,我们在清醒的时候,DNA损伤会在神经元中积累,且丰富的神经元活动会诱导DNA双链断裂。这种断裂可能由多种因素引起,包括紫外线、神经元活动、辐射、氧化应激和酶促错误。在我们睡眠期间,每个细胞内的修复系统都会纠正这些DNA断裂。然而,神经元中的DNA损伤会在清醒时继续积累,大脑中过度的DNA损伤会达到必须减少的危险水平。我们所发现的机制可以解释睡眠障碍、衰老和神经退行性疾病之间的联系,例如帕金森病和阿尔茨海默病。”
熬夜打乱睡眠规律,影响DNA损伤修复
日常生活中,有很多人因为生活所迫或职责所在,不得不熬夜,如医生、酒店服务员、安保等。那么,熬夜对他们的健康有什么影响呢?2019年1月23日,香港大学在Association of Anaesthetists发表题为“The effect of sleep deprivation and disruption on DNA damage and health of doctors”的研究成果(图4)[2]。该项研究是人类首批针对睡眠不足对基因的影响研究。

图4 研究成果(图源:Association of Anaesthetists)
此项研究调查了来自当地两家公立医院的49名健康的全职医生。其中,24人需要通宵接听现场电话,大部分人每月需要接听五到六个电话。剩余的25名医生不需要接听此类电话。通过对调查对象血液样本分析,总结了睡眠不足对基因的影响。
研究结果:与正常工作时间的医生相比,通宵接诊的普通医生的DNA断裂要高出30%;经过一夜的急性睡眠剥夺后,这种DNA损伤进一步增加了25%以上。睡眠不足的医生与DNA修复相关的基因活性水平较低。 研究人员表示:“对于夜间工作所需并进行如麻醉或手术等技术性工作的医生,我们真的应该尽量减少其夜间完成的手术数量。DNA损伤和较低的修复能力可能会带来更大的健康影响,如增加癌症基因突变的几率。这项研究的结果适用于工作模式与不定期上夜班的医生相似的人。也许你应该考虑调查你的睡眠习惯,不要熬夜,给DNA损伤留有充足的修复空间,更加尊重地对待睡眠。”
人体无时无刻的DNA损伤有哪些因果?
生物体内的基因组时刻都面临着内源和外源的威胁,每个细胞每天都要发生多达105次DNA损伤[3]。
1 内源因素
许多类型的DNA损伤是由细胞内存在的生理过程产物引起的。比如在DNA复制过程中偶尔出现的DNA错配、拓扑异构酶I和II活性丧失引起的DNA链断裂、非酶介导的DNA甲基化反应和水解反应等,这些生物学过程均会导致细胞每天产生数以千计的碱基损伤。除此之外,由于生物体需要氧化呼吸链提供生存所需的能量,所以处于活化状态的氧化呼吸会产生较多的对细胞有害的活性氧化合物,活性氧的存在会损害DNA碱基配对和阻碍DNA复制和转录,从而导致碱基的丢失或者DNA单链或者双链断裂[4]。
2 外源因素
除生理过程中导致的DNA损伤之外,自然界中同样存在较多影响DNA稳定性的不利因素。其中对DNA稳定性毒性最大的环境因素是空气中的紫外线。尽管太阳光谱中的最危险的部分—紫外线C能够被臭氧层大量的吸收,但是在较强的光照下,残余的紫外线A和紫外线B仍然能每小时每个细胞诱发大约105个DNA损伤位点。除紫外线之外,电离辐射同样能诱导细胞产生各种各样的DNA损伤,其中DNA双链断裂是威胁细胞基因组稳定性的最强的一种损伤类型。一些电离辐射是由天然放射性化合物的放射性衰变引起的,比如铀的衰变会产生放射性的氡气,这些氡气在室内积聚会诱发肺癌。在癌症的化疗过程中,也会接触到天然或者人造放射性同位素。除此之外,还有很多的化学药物也能引起比较严重的DNA损伤,比如自然界或者人为制造的一些致癌有害药物,癌症化疗药品等[5]。
在进化过程中,为了保证基因组染色体的完整性,机体已经进化出了一套识别并且准确修复DNA损伤的机制以应对损伤带来的危害。目前数百个与DNA损伤修复相关的基因已被确定,它们主要参与了五个不同的,但功能上又相互关联的途径:碱基切除修复(Base Excision Repair,BER),核苷酸切除修复(NucleotideExcision Repair,NER),错配修复(Mismatch Repair,MMR),非同源末端连接(Non-HomologousEend Joining,NHEJ)和同源重组(Homologous Recombination,HR)。根据DNA损伤类型的不同,机体分别以不同的方式对损伤进行修复。目前主要发现的修复方式有DNA双链断裂修复、DNA单链断裂修复、切除修复、错配修复、光复活修复(图5)[6]。
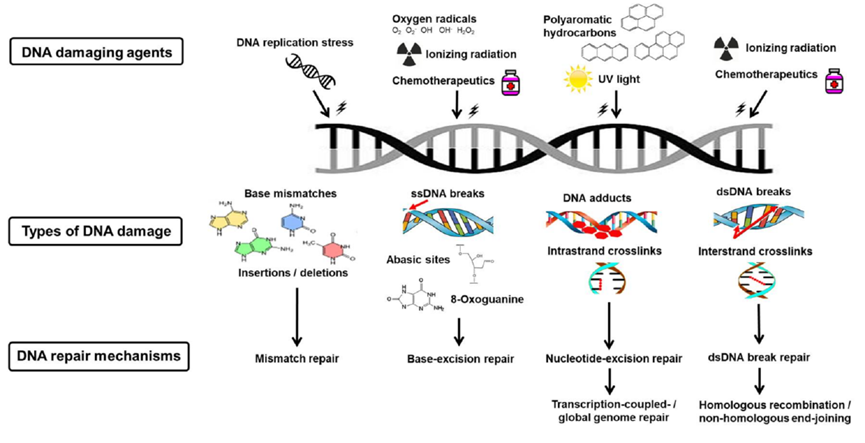
图5 DNA损伤与修复机制(图源:[7])
大多数DNA损伤皆可通过机体自我修复,不可修复的DNA损伤往往会带来一系列恶劣后果。DNA损伤如果不被及时修复,很可能会干扰细胞发挥正常的功能,例如肿瘤抑制因子等关键基因发生损伤,会大大增加细胞癌变的可能性。研究表明氧化应激脂质过氧化造成的DNA氧化损伤是肿瘤和其它慢性退行性疾病的重要致病机理。如结直肠癌的前期病变克罗恩病、溃疡性结肠炎、胰腺癌的前期病变慢性胰腺炎、以及肝癌有关的病毒性和酒精性肝炎、肝硬化等病理状态下DNA氧化损伤水平都显著升高[7]。
DNA损伤修复途径维持着细胞遗传物质的稳定,其功能的正常运转对于细胞来说至关重要。目前来看,当细胞内一种或多种修复途径缺陷时,往往会增加细胞发生癌变的风险。对于DNA损伤修复这一方向,包括新蛋白的鉴定以及结构功能解析、修复途径的完善等依然是未来生命科学领域的热点。此外,依托于基础理论的建立,未来新的作用靶点鉴定以及特异性抗癌药物的开发也将是生物医学领域的主要方向。
题图来源:Thred,仅用于学术交流。
撰文|文竞择
排版|乔维钧
参考资料:
[1]Zada D, Sela Y, Matosevich N, et al. Parp1 promotes sleep, which enhances DNA repair in neurons. Mol Cell. 2021 Dec16;81(24):4979-4993.e7. doi: 10.1016/j.molcel.2021.10.026. Epub 2021 Nov 18.PMID: 34798058; PMCID: PMC8688325.
[2] Cheung V, Yuen VM, Wong GTC, et al. The effect of sleep deprivation and disruption on DNA damage and health of doctors. Anaesthesia.2019 Apr;74(4):434-440. doi: 10.1111/anae.14533. Epub 2018 Sep 25. PMID:30675716.
[3]Hoeijmakers JH. DNA damage, aging, and cancer. N Engl JMed. 2009 Oct 8;361(15):1475-85. doi: 10.1056/NEJMra0804615. Erratum in: N EnglJ Med. 2009 Nov 5;361(19):1914. PMID: 19812404.
[4]Shi L, Oberdoerffer P. Chromatin dynamics in DNA double-strand break repair. Biochim Biophys Acta. 2012 Jul;1819(7):811-9. doi:10.1016/j.bbagrm.2012.01.002. Epub 2012 Jan 17. PMID: 22285574; PMCID:PMC3368990.
[5]Chapman JR, Taylor MR, Boulton SJ. Playing the end game: DNA double-strand break repair pathway choice. Mol Cell. 2012 Aug24;47(4):497-510. doi: 10.1016/j.molcel.2012.07.029. PMID: 22920291.
[6]Helena JM, Joubert AM, Grobbelaar S, et al. Deoxyribonucleic Acid Damage and Repair: Capitalizing on Our Understanding of the Mechanisms of Maintaining Genomic Integrity for Therapeutic Purposes. Int J Mol Sci. 2018 Apr11;19(4):1148. doi: 10.3390/ijms19041148. PMID: 29641431; PMCID: PMC5979424.
[7]Dedon PC, Plastaras JP, Rouzer CA, et al. Indirect mutagenesis by oxidative DNA damage: formation of the pyrimidopurinone adduct of deoxyguanosine by base propenal. Proc Natl Acad Sci U S A. 1998 Sep15;95(19):11113-6. doi: 10.1073/pnas.95.19.11113. PMID: 9736698; PMCID:PMC21604.