摘要:疫情当下,新冠特效药物的研发尤为重要。近日,礼来又一款新冠中和抗体获得FDA的紧急使用授权,以此为中心,本篇文章主要梳理了比较重磅的几款在研新冠特效药。
根据美国FDA官网消息,当地时间2月11日,FDA宣布批准礼来制药新冠中和抗体Bebtelovimab的紧急使用授权(EUA),主要用于治疗成人和12岁及以上儿童患者(至少40斤)的轻度至中度COVID-19患者(图1),以及有高风险发展成为重症COVID-19的群体。
剑指奥密克戎,Bebtelovimab可有效治疗新冠
值得一提的是,礼来此次获紧急使用授权的新药可用于治疗新冠病毒变异毒株奥密克戎。

图1 Bebtelovimab EUA授权书截图(图源:FDA官网)
根据对所有可用科学数据的审查,FDA确定有理由相信Bebtelovimab或可有效治疗某些轻度或中度COVID-19患者。此次紧急使用授权的获批主要基于一项临床试验,这项试验评估了单独使用Bebtelovimab以及联合使用Bebtelovimab和其他单克隆抗体治疗轻度至中度COVID-19的疗效。试验结果显示,与安慰剂相比,使用Bebtelovimab治疗可以有效缩短症状持续时间,并且在治疗5天后,能够观察到患者体内病毒载量显著降低。
这款单抗药物需要静脉注射,通过与新冠病毒表面的刺突蛋白结合发挥作用,可以降低新冠病毒引起的住院和死亡风险。相关实验证明,这款新冠治疗药物对奥密克戎毒株及其亚型变异毒株BA.2均显示出中和活性。注射这款药物后可能出现的副作用包括瘙痒、皮疹、输液相关反应、恶心和呕吐。
多家药企同时发力,新冠特效药研发多点开花
除了近日被授予紧急使用授权的Bebtelovimab,目前国内外已有多种新冠特效药被获批使用或正在研究当中。
1 国外多种新冠药物被授予紧急使用授权
就在同一天,中国国家药品监督管理局(NMPA)根据《药品管理法》的相关规定,按照药品特别审批程序,进行应急审评审批,附条件批准辉瑞新冠病毒药物奈玛特韦片/利托那韦片组合包装(Paxlovid)进口注册(图2)。
图2 公告信息(图源:NMPA)
该药品为口服小分子新冠病毒治疗药物,用于治疗成人伴有进展为重症高风险因素的轻至中度新型冠状病毒肺炎(COVID-19)患者,比如伴有高龄、慢性肾脏疾病、糖尿病、心血管疾病、慢性肺病等重症高风险因素的患者。去年12月22日,FDA批准Paxlovid的紧急使用授权,根据EPIC-HR研究,该药可以将住院或死亡风险降低89%。
Paxlovid由尼玛瑞韦和利托那韦组成,以两片尼玛瑞韦和一片利托那韦片的形式给药,每天口服两次,持续5天。之前,辉瑞公布了Paxlovid额外的2/3期EPIC-HR临床试验的研究结果,证明了该药在降低新冠感染患者住院或死亡风险的强大功效。研究结果显示,与安慰剂相比,在症状出现后三天内接受治疗的患者中,与COVID-19相关的住院或全因死亡减少了89%。并且,与安慰剂相比,接受Paxlovid治疗的患者体内第5天的病毒载量相较于基线水平降低了约10倍,说明Paxlovid对新冠病毒具有强大的活性。
更重要的在于,Paxlovid对当下快速传播的奥密克戎变异毒株仍然具有效力。体外数据表明,尼玛瑞韦是奥密克戎3CL蛋白酶的有效抑制剂,结合现有的其他关注变体(VoC)包括Delta的体外抗毒和蛋白酶抑制数据,表明Paxlovid将对VoC以及其他新冠病毒变体保持强大的抗病毒活性。从原理上看,Paxlovid是通过与病毒的主链相结合以阻断病毒复制蛋白酶Mpro,而值得一提的是Mpro是新冠病毒中不会发生突变的部分之一。因而,目前来看,Paxlovid是最能防御变异毒株的新冠药物之一,算得上是病毒变异的“克星”。
另外,去年12月23日,默沙东与Ridgeback的新冠口服药物molnupiravir获得FDA紧急使用授权。与辉瑞的Paxlovid相比,molnupiravir仅能用于治疗18岁以上的高危患者,患者应该在症状出现5天内使用molnupiravir,每天服用8片,连续服用5天。去年11月初,molnupiravir由于在三期临床中期分析中呈现出令人欣喜的数据,因此提前终止试验,并向美国FDA申请该药品的紧急使用授权,而此次获得英国批准也是基于三期MOVe-OUT临床试验中期分析结果。
2 国内新冠药物研发如火如荼
除了上述国外新冠特效药,把目光收回国内,可以看到国内新冠特效药的研发也正如火如荼地进行。
2月11日,开拓药业宣布其普克鲁胺治疗轻中症新冠患者的全球多中三期临床试验已经在深圳市第三人民医院完成中国首例受试者入组及给药(图3)。普克鲁胺是一款雄激素受体拮抗剂和降解剂,对新冠感染早期和中后期均有很好的治疗疗效。
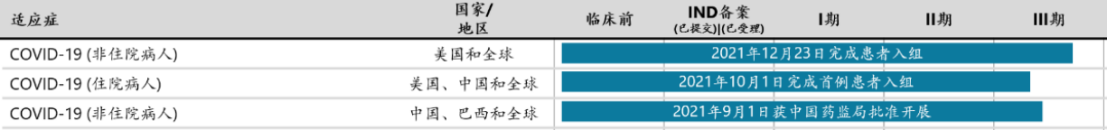
图3 普克鲁胺研发进展(图源:开拓药业官网)
值得一提的是,2021年9月,在中国国际服务贸易交易会上,国药集团中国生物天坛生物带来了新冠特效药——静注COVID-19人免疫球蛋白(简称“新冠特免”),这是全球首款采用新冠灭活疫苗免疫后血浆制备的新冠治疗药物,是我国在新冠病毒治疗领域的一个突破性成果。2月15日,天坛生物发布公告,宣布静注COVID-19人免疫球蛋白已于去年10月获得阿联酋临床试验批件,目前已根据药品临床试验的要求完成临床伦理审查、临床用药清关、临床前入组等工作,将于近日在阿联酋开展Ⅱ期临床试验。
另外,在国内新冠抗体药物方面,由清华大学、深圳市第三人民医院和腾升华创联合开发的安巴韦单抗/罗米司韦单抗联合疗法进展较快(图4),该抗体联合疗法已在中国获批,并在美国向FDA提交了紧急使用授权申请。针对奥密克戎的体外嵌合病毒实验数据表明,安巴韦单抗/罗米司韦单抗联合疗法对奥密克戎和其他广受关注的新冠病毒变异毒株均保持中和活性,包括德尔塔和德尔塔+。
![]()
图4 安巴韦单抗/罗米司韦单抗联合疗法研发进展(图源:腾盛博药官网)
目前,腾盛博药的安巴韦单抗/罗米司韦单抗联合疗法的紧急使用授权申请正在审核当中,这一联合疗法的紧急使用授权申请基于国际三期临床结果。研究结果显示,安巴韦单抗/罗米司韦单抗联合疗法能够使临床进展高风险的新冠门诊患者住院和死亡风险降低80%,并且该抗体联合疗法的临床安全性显著优于安慰剂。
除了以上新冠特效药物之外,还有下列新冠特效药的研发进度值得关注(表1)。
表1 目前国内外在研新冠特效药物
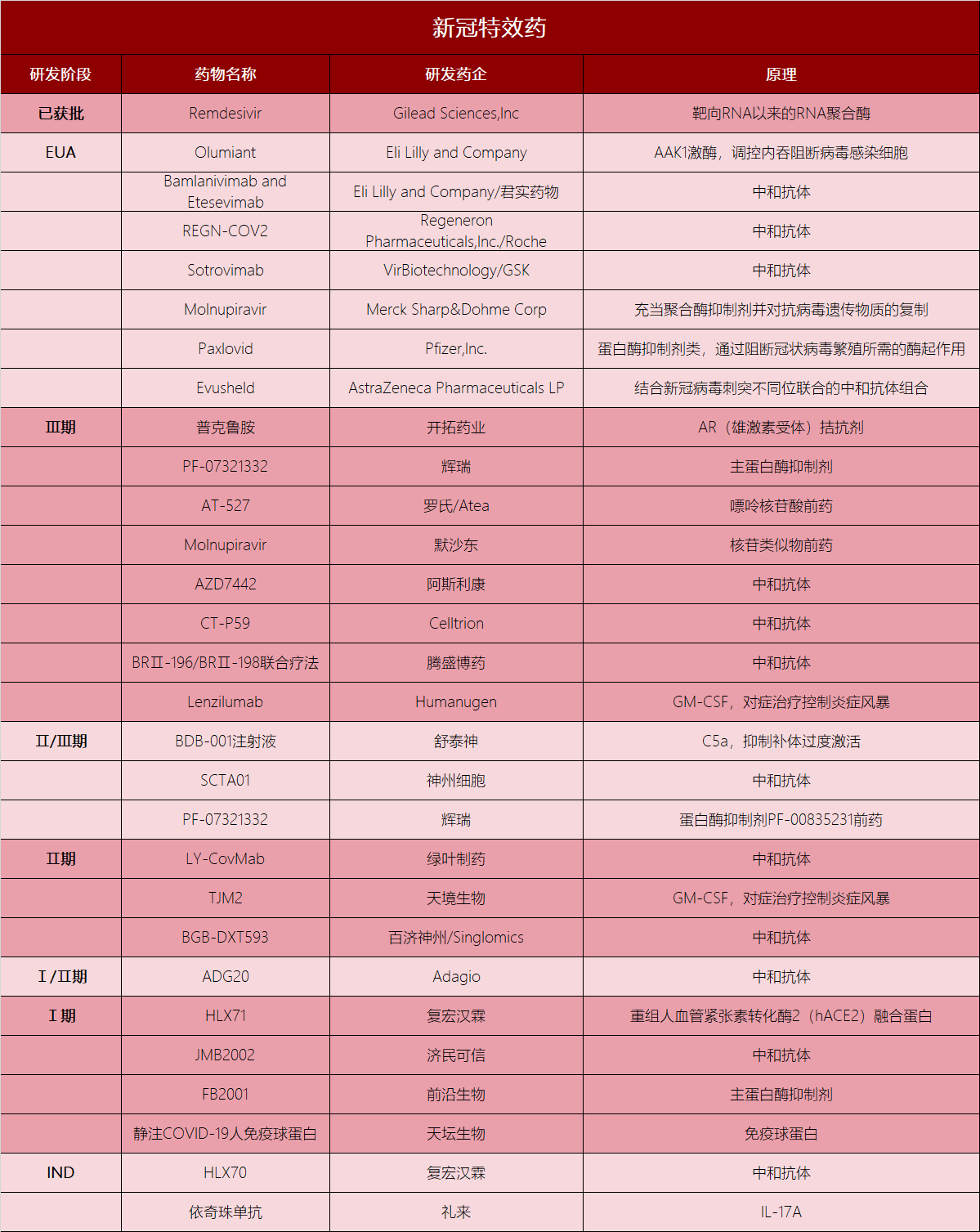
数据来源:FDA官网|制表:生物探索编辑团队
结语
去年年底,疫情席卷西安和郑州两座城市,如今奥密克戎再次攻击苏州,短短几日,已经新增确诊病例79例,足以看出奥密克戎强大的传播力度。一直以来,针对新冠病毒我们都是以防控为主,但是总会出现疏漏环节,造成病毒小范围内的快速传播,因而,尽快研发出感染新冠病毒之后能够有效治疗感染者的新冠特效药物迫在眉睫,至关重要。
以上我们梳理了部分新冠特效药,这些新冠药物如果能顺利上市,将会与已有的新冠疫苗友好互补,形成抗击新冠病毒的巨大合力。但是需要注意的是,新冠特效药物主要用于新冠病毒暴露后的干预治疗,无法有效预防新冠病毒的袭击,不能替代新冠疫苗的作用。
题图:礼来官网,仅用于学术交流
撰文|木子久
排版|木子久
参考资料:
[1]国家药监局应急附条件批准辉瑞公司新冠病毒治疗药物奈玛特韦片/利托那韦片组合包装进口注册。
[2]有效性数据“存疑” 默沙东新冠特效药在欧洲上市审批遇阻。
[3]天坛生物(600161.SH):“静注COVID-19人免疫球蛋白(pH4)”在阿联酋开展Ⅱ期临床试验。
[4]腾盛博药宣布安巴韦单抗/罗米司韦单抗联合疗法保持对新冠病毒变异株“奥密克戎”的中和活性。
[5]重磅!新冠特效药千呼万唤始出来,或在年底前上市。







