本文转载自“丁香学术”微信公众号。
哺乳动物的肠道存在一个复杂的微生物群落,包含细菌、真菌、病毒和寄生虫等。虽然说该群落主要由对消化至关重要的共生细菌组成,但也包括机会致病菌和明显的致病细菌和真菌,这些微生物的存在对机体带来了多方面的免疫挑战,例如,蠕虫可引起肠上皮损伤,并引起肠道细菌对组织的侵袭。
为了应对这些不同的微生物挑战,肠上皮细胞会产生多种抗菌蛋白(AMPs),这些抗菌蛋白分泌并覆盖在肠上皮的粘液层,限制细菌与上皮的接触,并可通过靶向微生物的细胞壁或细胞膜结构来快速灭活微生物。
2021 年 11 月 5 日,美国德克萨斯大学西南医学中心的 Lora V. Hooper 课题组胡泽汗和张晨璐等研究人员在国际顶级杂志 Science 在线发表了题为 Small proline-rich protein 2A is a gut bactericidal protein deployed during helminth infection 的研究性文章,他们筛选并鉴定了一种新型肠道抗菌蛋白 SPRR2A(Small proline-rich protein 2A),并通过一系列的体内外实验探究了其在机体肠道微生物组成调控以及限制致病性细菌感染的内在机制,强调了该蛋白在肠道寄生虫蠕虫感染条件下的保护作用。
总之,这项研究不仅能加深并拓展对肠道与微生物相互作用分子机制的理解,也为将来开发新的预防和治疗相关疾病的药物和方法提供理论依据。

(图片来源:Science)
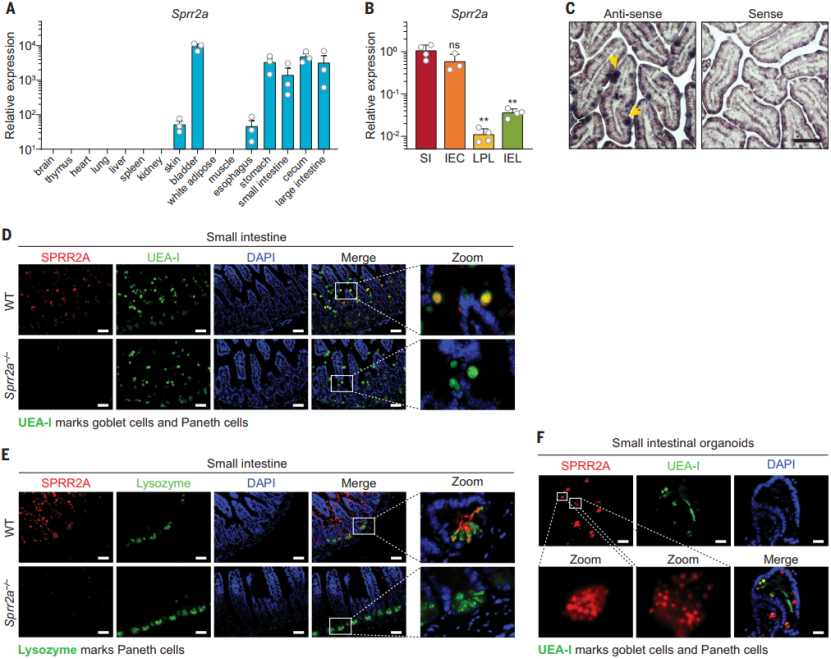
SPRR2A 在小鼠肠道的杯状细胞和潘氏细胞中高表达
在前期的研究中,通过比较分析无菌小鼠在定植肠道微生物前后肠上皮细胞的转录组信息,该团队发现 SPRR2A(Small proline-rich protein 2A)的表达在肠道菌群定植以及病原菌感染情况下会显著上调,这也提示该蛋白在菌群定植和抵御感染层面可能发挥着重要的作用。
为了验证这一假设,研究人员系统检测了小鼠体内多个组织和器官中的 SPRR2A 的表达,发现其在与外界环境接触的组织中含量最为丰富,包括胃肠道、膀胱和皮肤。在肠道中,SPRR2A 在肠上皮细胞(IEC)中特异高表达。进一步的研究发现 SPRR2A 存在于杯状细胞和潘氏细胞内的分泌颗粒样结构中,提示 SPRR2A 可能分泌到肠腔中,后续他们也在粪便和结肠粘液层中检测到 SPRR2A 的存在。总之,这些观察结果表明,小鼠 SPRR2A 在肠分泌上皮细胞中选择性表达,并可分泌到肠腔中。
(图片来源:Science)
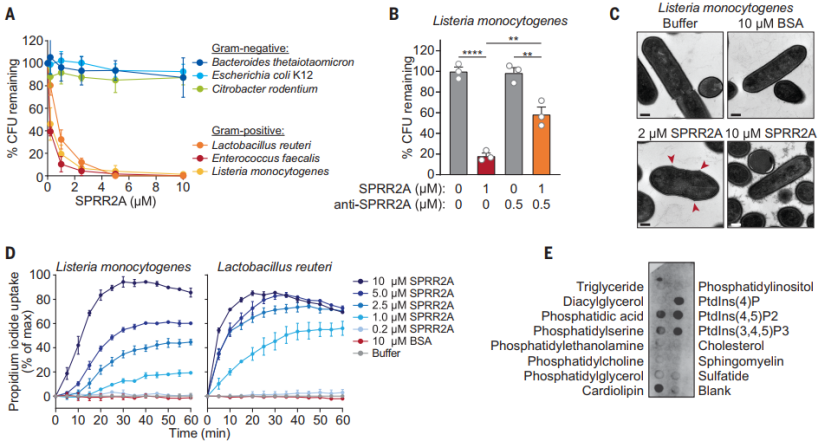
SPRR2A 通过膜渗透作用靶向革兰氏阳性菌
为了检测 SPRR2A 的杀菌活性,研究人员制备了重组人 SPRR2A,并对其进行纯化。随后,他们将纯化的 SPRR2A 添加到包括革兰氏阳性和革兰氏阴性菌的肠道共生菌和致病菌中。结果发现,革兰氏阳性菌,包括罗伊氏乳杆菌、粪肠球菌等对其敏感;相比之下,革兰氏阴性菌,如大肠杆菌和柠檬酸杆菌等,对 SPRR2A 具有耐药性。因此,SPRR2A 是一种选择性杀死革兰氏阳性细菌的新型抗菌蛋白。
为了了解 SPRR2A 是如何杀死细菌的,他们使用透射电子显微镜观察了革兰氏阳性细菌在 SPRR2A 干预下的形态变化,发现了其细胞壁损伤和细胞质渗漏,表明 SPRR2A 通过渗透细菌膜来杀死细菌。
( 图片来源:Science)
后续的实验还发现 SPRR2A 与带有负电荷脂类的脂质体结合,这反映了大多数细菌膜的酸性特征。为了检测 SPRR2A 是否会破坏细菌膜结构,他们将纯化的 SPRR2A 添加到脂质体中,通过负染色电镜观察到的脂质体被完全破坏,只剩下膜碎片。这些结果表明,SPRR2A 能够破坏膜,但内在的机制不同于其他已知微生物诱导的 AMPs。
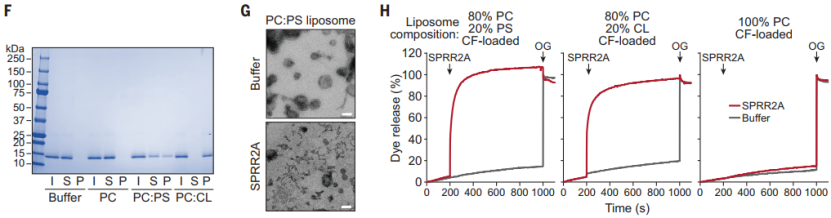
(图片来源:Science)
Sprr2a-/-小鼠肠道微生物群发生改变
上述实验证实了 SPRR2A 的杀菌能力,也提示着 SPRR2A 可能具有调节肠道微生物群组成、细菌与肠道表面的接触、病原体定植的功能。
为了在体内检测这些效应,他们首先构建了缺乏 SPRR2A 的小鼠 Sprr2a-/-。野生型和 Sprr2a-/-小鼠肠道菌群的 16S rRNA 基因序列分析结果表明,Sprr2a-/-小鼠小肠内革兰氏阳性菌丰度增加;同时,随着时间的推移,类杆菌(一类革兰氏阴性细菌)的数量在减少。这与上述的发现也是一致的,即 SPRR2A 选择性地杀死革兰氏阳性细菌,并且 SPRR2A 能够塑造小肠腔内细菌群落的组成。
在分析小肠粘液相关细菌时,同样检测到革兰氏阳性细菌丰度增加,革兰氏阴性拟杆菌丰度减少,表明 SPRR2A 也能够调节小肠粘液层的革兰氏阳性定植,并限制细菌与小肠表面之间的相互作用。

(图片来源:Science)
接下来,他们评估了 Sprr2a-/-小鼠对细菌病原体的易感性。与野生型小鼠相比,革兰氏阳性细菌-利斯特氏菌感染可导致肠系膜淋巴结、肝脏和脾脏的细菌负荷增加,同时,在高剂量处理时也表现出较高的死亡率。这些数据表明 SPRR2A 在体内可防止革兰氏阳性细菌病原体的感染。
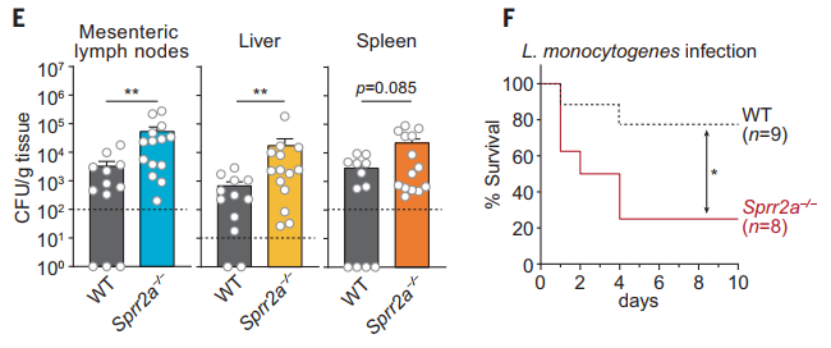
(图片来源:Science)
肠道蠕虫感染可诱导 SPRR2A 的表达
肠道蠕虫感染可引起多种病理生理反应,包括肠上皮损伤,而这会进一步促进细菌突破肠屏障,造成对机体的重大伤害。研究人员发现,当使用蠕虫感染小鼠时,其十二指肠和近端空肠中 SPRR2A 的转录会显著增加,空肠中也会出现更多产生 SPRR2A 的杯状细胞,同时单个细胞中的 SPRR2A 的表达也在增加。这些数据表明,蠕虫感染可诱导 SPRR2A 的高表达,并且其高于细菌定植诱导的水平。
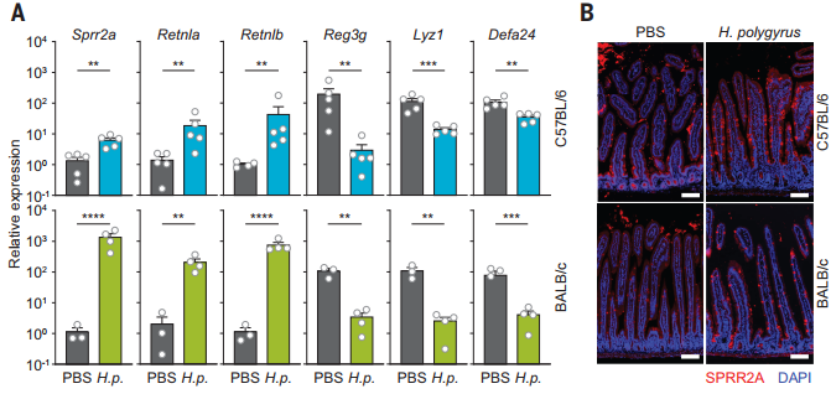
(图片来源:Science)
鉴于蠕虫感染可在肠道中诱导强烈的 2 型免疫,那么 SPRR2A 的高表达是否由 2 型细胞因子如 IL-4 或 IL-13 诱导产生的呢?
研究人员利用小肠类器官来探索了这个问题。结果发现,野生型小肠的类器官暴露于 IL-4 和 IL-13 时,SPRR2A 表达增加;但当暴露于其他细胞因子,如 IFN-g、IL-1b 和 IL-22 时,SPRR2A 表达并不增加。此外,向野生型小鼠腹腔注射 IL-13(而非 IL-22)也会增加小肠中 SPRR2A 的表达,更加深入的分析发现转录因子 STAT6 介导了这一效应。综上这些数据表明,2 型细胞因子可通过 IL-4/13-STAT6 通路来增加小肠中 SPRR2A 的表达。
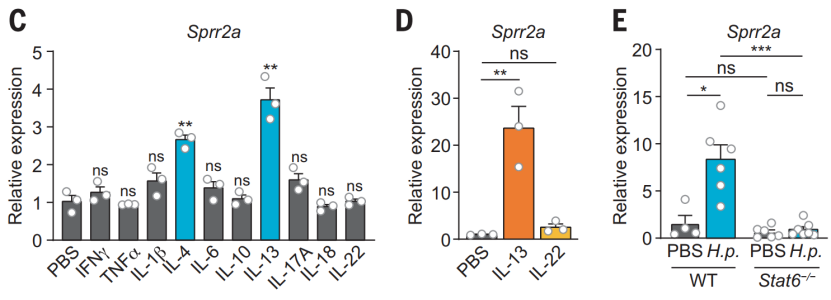
(图片来源:Science)
SPRR2A 可防止蠕虫引起的肠道细菌入侵
最后,他们评估了 SPRR2A 对肠道蠕虫感染的影响以及随之而来的 2 型免疫反应。结果发现,SPRR2A 并不会直接影响蠕虫本身以及由其引起 2 型免疫反应的能力,但SPRR2A 会在蠕虫感染的后期通过影响蠕虫的适应度而对其进行清除。
紧接着,他们发现 SPRR2A 蛋白的表达量在寄生虫感染时显著提高,提示其可能在出血过程中保护肠道屏障。后续的小鼠感染模型也证实了这一点,即当用蠕虫感染 Sprr2a-/-小鼠的肠道后,其肠道组织以及肠系膜淋巴结(mLN)中出现了大量的肠道菌群易位以及更高的细菌负荷,提示其肠黏膜抗菌屏障受到损伤。总之,这些数据表明,SPRR2A 在机体遭受肠道寄生虫感染时,对于抵抗肠道细菌入侵以及维持肠道的抗菌屏障功能起着非常关键的作用。
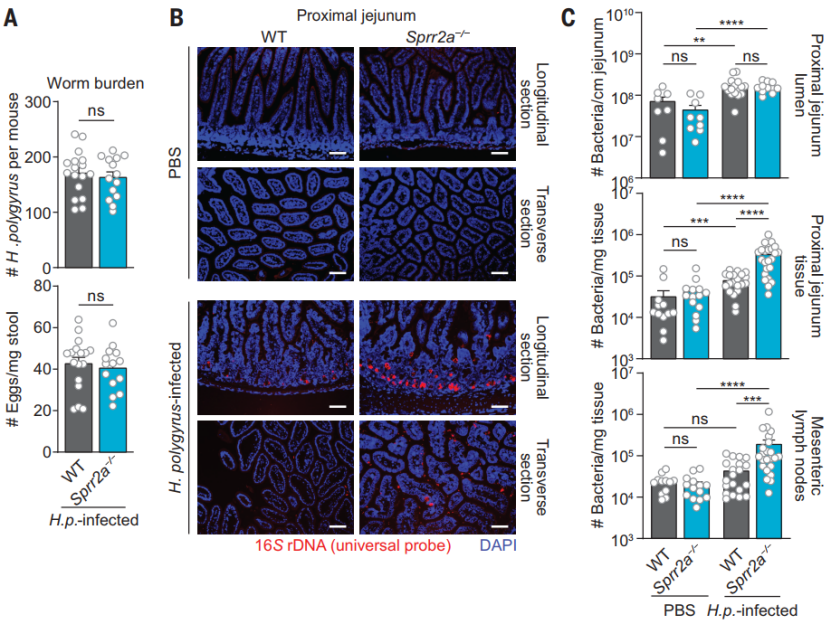
(图片来源:Science)
综上所述,该团队通过一系列的体内外实验验证了 SPRR2A 作为一种新型肠道抗菌蛋白的作用,并且这一蛋白可由细菌和寄生虫感染时通过不同的途径诱导产生,这也是国际上首次报道 SPRR 家族成员在小鼠中具有协助机体抵御外源病原体感染并维持健康肠道微生态的功能。
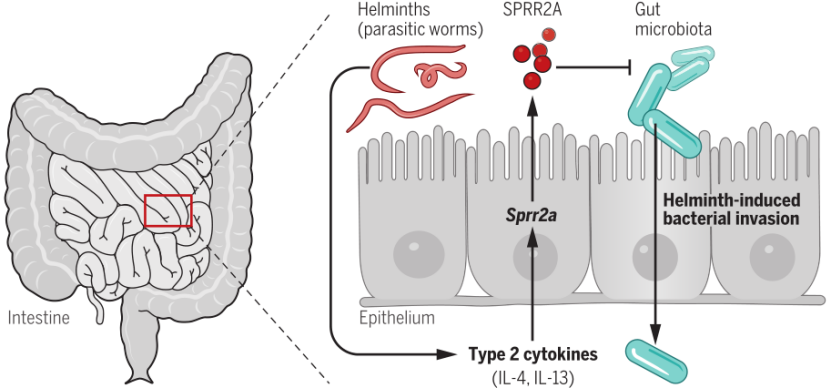
(图片来源:Science)
同期 Science 刊发了针对该研究的专门评述 A helminth-induced antimicrobial protein,专家指出,这项研究不仅发现了新的肠道抗菌蛋白,拓展了我们对肠道抗菌蛋白的认识,而且研究人员对通过对其调控和作用机制的解析更是帮助我们认识了人类肠道抗菌蛋白-肠道菌群-致病菌感染之间的复杂调控和相互影响。
参考资料:
1.Z. Hu et al., Science 374, eabe6723 (2021). DOI: 10.1126/science.abe6723.
2.A. Rapin, N. L. Harris, Helminth-bacterial interactions: Cause and consequence. Trends Immunol. 39, 724–733 (2018). doi: 10.1016/j.it.2018.06.002; pmid: 29941203.
3.L. V. Hooper et al., Molecular analysis of commensal hostmicrobial relationships in the intestine. Science 291, 881–884(2001). doi: 10.1126/science.291.5505.881; pmid: 11157169.