本文转载自“丁香学术”微信公众号。
白血病,严重威胁人类健康的一类疾病,由于其复杂的致病机制和特点,可根据病程(急性白血病与慢性白血病)和白血病细胞的起源(髓系白血病与淋系白血病)分为多种类型。到目前为止,化疗仍然是临床上治疗白血病的主要策略。
在这些化疗药物中,三氧化二砷(ATO),即砒霜,是治疗急性早幼粒细胞白血病(APL)的一线药物。三价砷作为一种药物,主要通过诱导凋亡发挥抗白血病作用。然而,临床应用中的 ATO 是一种离子制剂(ATO 注射液),在体内可迅速被清除,此外,这种非靶向药物分布亦可引起毒副作用,而且这种离子制剂在其他类型白血病细胞中的吸收效率甚至更低,从而限制了其应用于其他类型白血病。因此,临床上迫切需要制定新的策略,以有效地将三价砷用于不同类型白血病的治疗。
为了实现这一目标,一种可能的方法是在白血病细胞上发现新的靶点,并构建相应的三价砷载体进行运载。
2021 年 10 月 25 日,北京大学马丁教授、中国科学院过程工程研究所生化工程国家重点实验室研究员马光辉研究员、魏炜研究员联合南方医科大学珠江医院李玉华教授开展了紧密合作,并在 Nature Nanotechnology 在线发表了题为 Ferritin-based targeted delivery of arsenic to diverse leukaemia types confers strong anti-leukaemia therapeutic effects 的研究性文章。
他们利用体内存在的天然铁蛋白颗粒(Fn)作为药物载体,解决了高效装载 ATO 以及精准靶向输送的难题,临床样本数据和患者来源的异种移植模型的数据表明,该策略能够显著抑制多种白血病的进展,其治疗效果显著优于现有的单独 ATO 和联合化疗策略。

( 图片来源:Nature Nanotechnology)
主要研究内容
白血病细胞高表达 CD71
考虑到快速增殖的白血病细胞对铁的需求以及已知的实体瘤中的 CD71 水平升高,研究人员假设白血病细胞可能表现为 CD71 的高表达。为了验证这一假设,他们从健康供者外周血样本和白血病患者的骨髓样本中检测了不同类型细胞的 CD71 表达水平。结果表明,CD71 在健康供者的各种细胞类型中的表达均非常低,此外,健康供者不同外周血细胞类型之间的 CD71 丰度也没有偏差。
但是,相比之下,不同类型白血病患者细胞的分析表明,白血病细胞显著高表达 CD71。另外,白血病细胞高表达 CD71 的比例高于百分之九十。在对细胞类型分布进行配对分析后发现,CD71 显示出高度的白血病细胞特异性。上述的这些数据也支持了 CD71 作为新靶点用于开发治疗白血病的新型精确疗法的可能性。
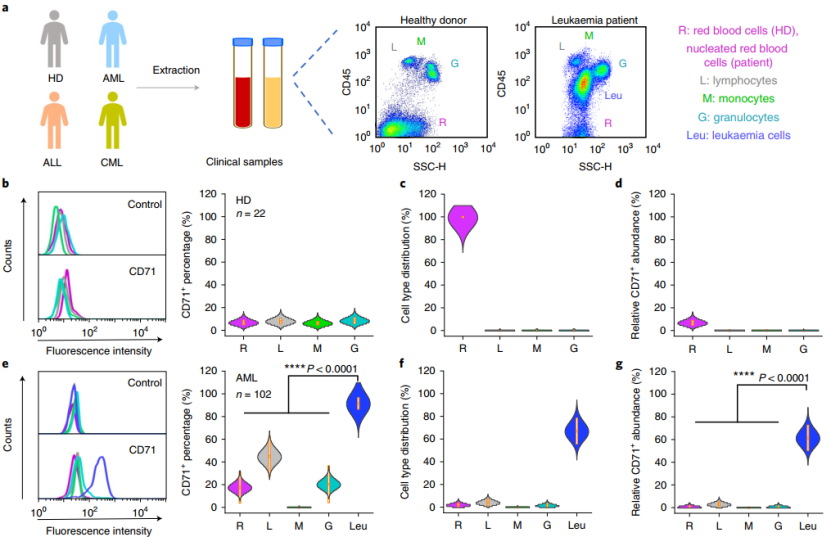
(图片来源:Nature Nanotechnology)
As@Fn 的设计原理
考虑到砷剂的结构非常小,研究人员希望将其装载到具有非常小孔径的脱铁蛋白中。此外,鉴于铁蛋白对铁离子具有天然的吸附能力以及对高温的良好耐受性,在脱铁蛋白内进行高温处理以形成 Fe–O–As 纳米复合物是可行的,而这种设计将有助于在白血病细胞中特异性释放之前保留的高细胞毒性的三价砷离子。
基于上述设计,研究人员成功获得了砷基铁蛋白(As@Fn)。X 射线图像分析也证明了铁和砷的存在。高分辨率像差校正电子显微镜结果进一步证实了砷和铁在纳米复合物中的精确分布等。
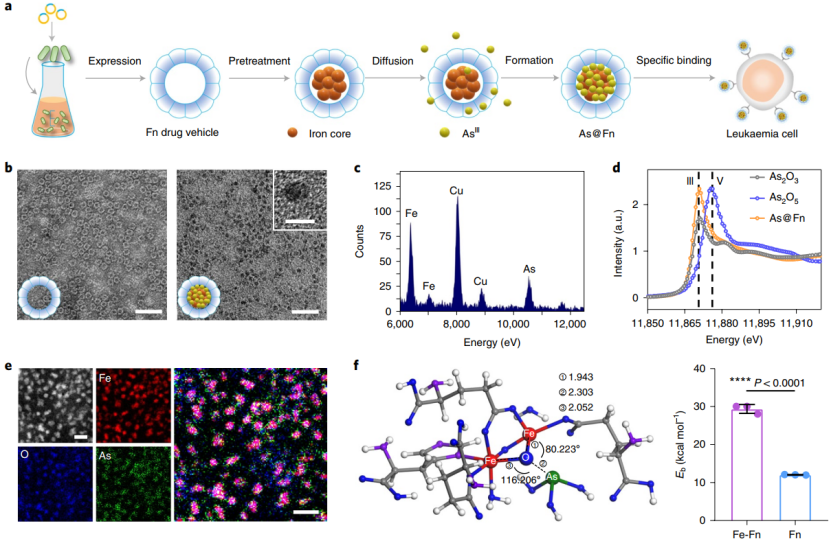
(图片来源:Nature Nanotechnology)
As@Fn 的体内靶向能力
为了比较 ATO 和 As@Fn 在白血病小鼠体内的生物分布,他们构建了 HL-60 白血病小鼠模型。分析结果表明,As@Fn 与 ATO 组相比,As 在心脏、肝脏、脾脏、肺、肾和脑中的分布在正常对照组显著降低,表明 As@Fn 对于正常器官的毒副作用明显减少。药代动力学曲线显示,As@Fn 比 ATO 长 6 倍,即显著增加了药物在体内的保留时间。
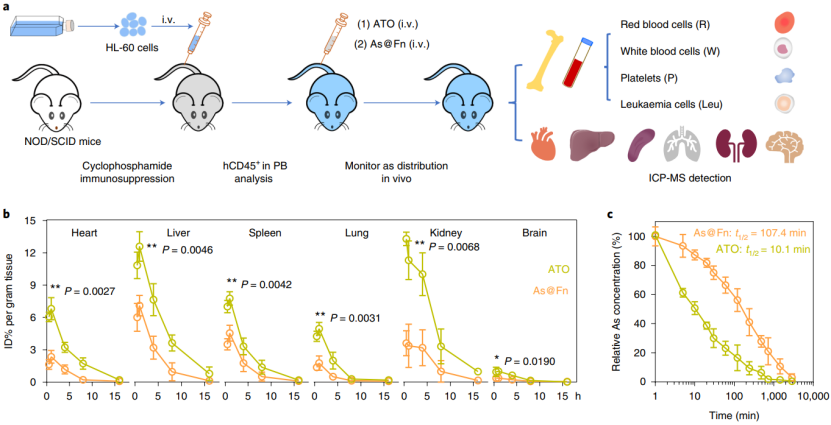
(图片来源:Nature Nanotechnology)
随后,他们用 Cy3 来标记 As@Fn,静脉注射后观察其在不同血细胞间的分布。结果发现,Cy3 强信号在白血病细胞而非其他正常血细胞类型,说明了 As@Fn 能够精准有效地输送到白血病细胞。
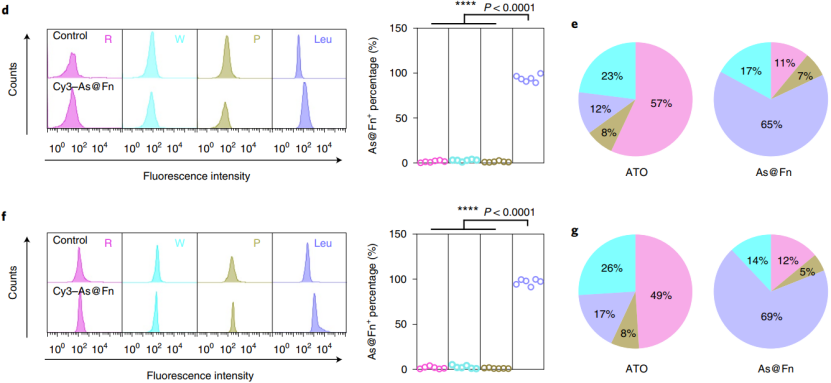
(图片来源:Nature Nanotechnology)
As@Fn 体内抑制白血病的发生
接下来,他们构建了一个 AML 的小鼠模型,该模型含有稳定表达荧光素酶的 HL-60 细胞,这些小鼠被随机分为四组:磷酸盐缓冲盐水(PBS)对照组、Fn 组、ATO 组和 As@Fn。和预期一致,PBS 对照组的生物发光信号迅速扩散,表明恶性程度较高。对白细胞(WBC)计数和体重的分析结果表明,As@Fn 治疗优于其他组别,再次支持了 As@Fn 的强抗白血病的作用。
各种组织学的观察也显示,As@Fn 组 PB、BM 和脾脏中的白血病具有明显的被抑制作用。此外,As@Fn 有效的治疗效果也使得小鼠的存活时间显著延长。
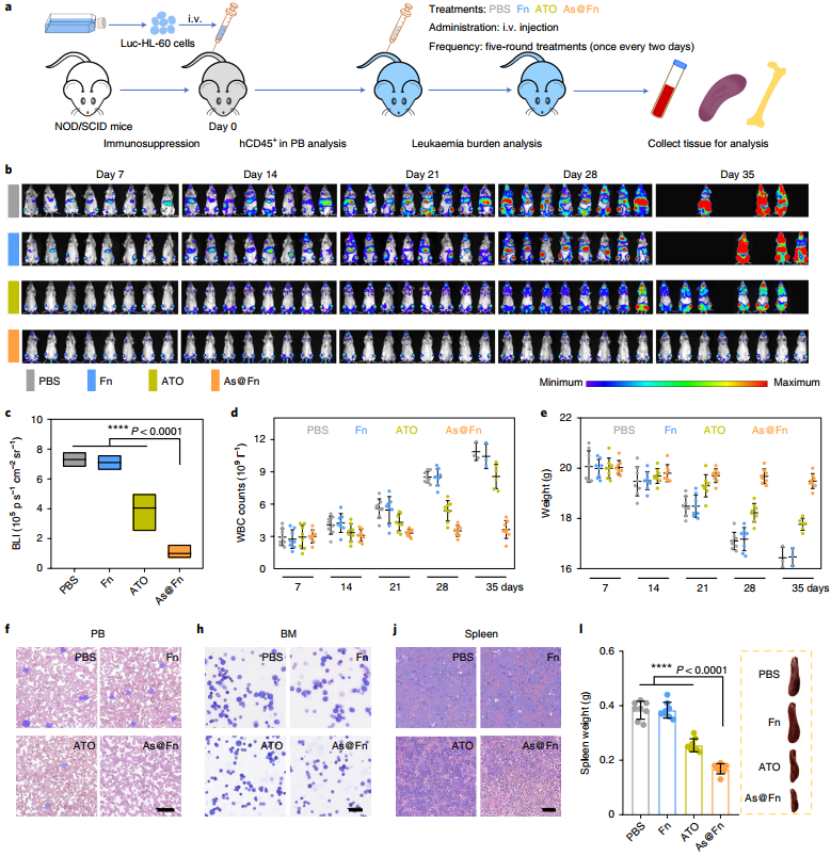
( 图片来源:Nature Nanotechnology)
为了进一步评估 As 制剂的潜在临床效用,他们建立了 ALL-PDX 模型(ALL 患者来源的异种移植模型)。首先,他们从 PDX 模型小鼠的骨髓和脾脏中获得人类白血病细胞,并用于体外评估。结果发现它们的确高表达 CD71,并且其阳性率超过 95%。随后,一项饱和结合分析实验也证实了白血病细胞中该基因和 As@Fn 经强受体介导的的特异性结合。
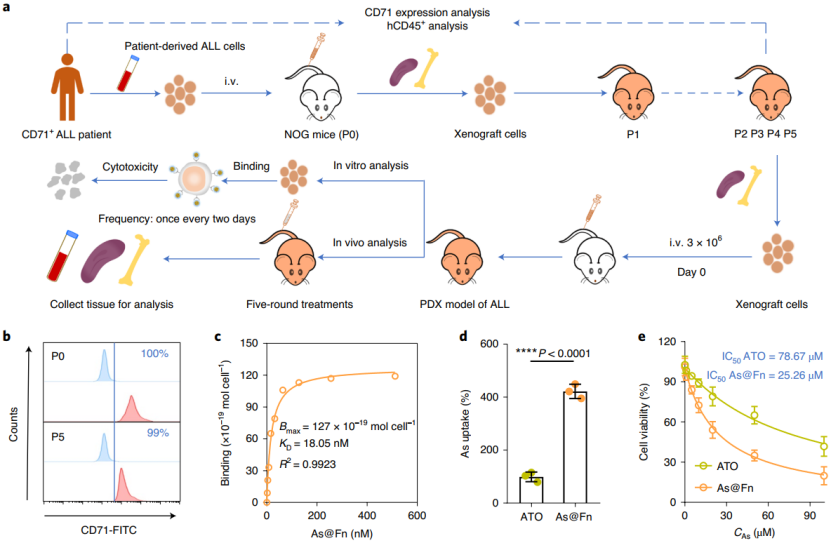
( 图片来源:Nature Nanotechnology)
成功建立 PDX 模型小鼠后,他们进行了更加深入的体内实验,并将其随机分为四个治疗组:PBS,常用的长春新碱和地塞米松联合疗法,ATO 和 As@Fn 组。结果发现,As@Fn 组显示出强大的抗白血病作用,优于其他疗法,并且副作用较小,最终使得小鼠的存活时间显著延长。
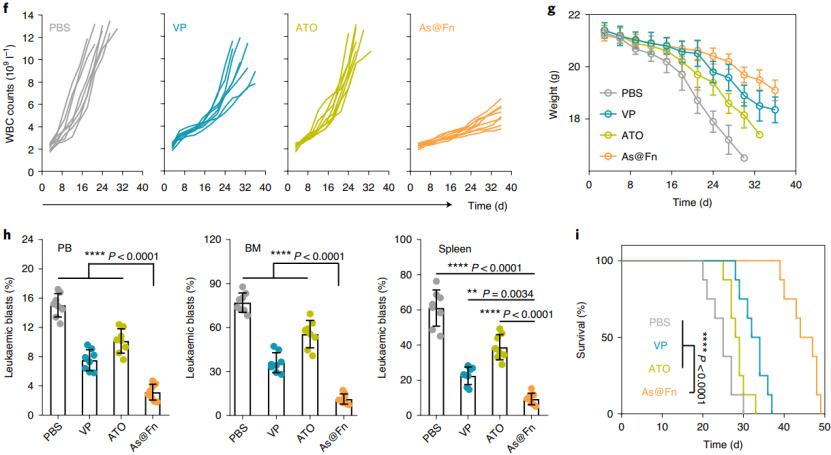
( 图片来源:Nature Nanotechnology)
结语 综上所述,基于临床数据,研究人员发现了白血病细胞高表达 CD71 的现象,随后他们利用配体蛋白合理设计了一种仿生载体,用于精确递送三价砷。研究结果表明,As@Fn 纳米药物与具有高 CD71 表达的 HL-60 AML 白血病细胞具有较高亲和力,比 ATO 发挥更强的细胞毒性作用。
通过多种细胞系分析、异种移植实验和 PDX 模型验证,一起突出了 As@Fn 作为白血病治疗剂的强大潜力,不过上述成果仍属于临床前研究,实际临床疗效仍有待进一步验证。
但是,鉴于 Fn 为人体内源组分并且 ATO 为已批准用药,因此推测该制剂具有较好的临床转化潜力。据悉,该团队正在按照相关要求推进后续的研发和转化,希望能够尽快造福于白血病患者。
参考资料:
1.Wang, C., Zhang, W., He, Y. et al. Ferritin-based targeted delivery of arsenic to diverse leukaemia types confers strong anti-leukaemia therapeutic effects. Nat. Nanotechnol. (2021).
2.Short, N. J. et al. Advances in the treatment of acute myeloid leukemia: new drugs and new challenges. Cancer Discov. 10, 506–525 (2020).
3.Zhang, X. W. et al. Arsenic trioxide controls the fate of the PML-RARα oncoprotein by directly binding PML. Science 328, 240–243 (2010).







