本文转载自“丁香学术”微信公众号。
在人体内,许多蛋白质的丰度表现出 24 小时的节律特征,即由细胞自主的昼夜节律机制调节,使其生理学功能与昼夜周期一致。这种蛋白质稳态允许哺乳动物的细胞能够最有效地利用生物能资源。但是,截止目前,科学家们还不清楚细胞内不同结构内的细胞蛋白浓度随昼夜节律的变化情况。
其中,心脏功能的每日节律多年来一直为人所知,并被认为是由白天神经系统的刺激所致。但是,心脏细胞内的昼夜节律以及其与心脏健康之间的关系仍然是未知的。
2021 年 10 月 15 日,由英国剑桥 MRC 分子生物学实验室的科学家领导团队在 Nature Communications 在线发表了题为 Compensatory ion transport buffers daily protein rhythms to regulate osmotic balance and cellular physiology 的研究性文章,他们描述了心脏细胞通过细胞内钠离子和钾离子水平的变化来调节昼夜节律。心脏细胞内外不同水平的钠离子和钾离子引起电脉冲调控心脏收缩并驱动心跳。
同时发现,细胞离子浓度的动态变化可以驱动细胞生理学的变化,从而对心肌细胞功能和心率进行精确的时间调节,使我们在活动时能够更好地适应和维持心率。
此外,了解这些离子水平的变化如何在一天的节律中改变心脏功能,可能有助于解释为什么轮班工人更容易患心脏病,这一新的认识也可能为抵御心脏疾病提供更好的预防和治疗措施。

(图片来源:Nature Communications)
可溶性蛋白丰度的细胞自主节律
细胞内蛋白质组表现出 24 小时的周期节律,部分原因在于 mTORC1 活性、核糖体生物发生和整体蛋白质合成速率的昼夜节律。首先,研究人员证实,成年小鼠的成纤维细胞中,mTORC1 活性节律能够自动发生。
此外,虽然总蛋白质水平没有发生改变,但胞质和核/细胞器之间的蛋白质丰度呈现倒数变化,这与细胞自主的每日节律相一致,即细胞溶质蛋白质被隔离到其他细胞室或无膜细胞器。这些数据也说明,蛋白质日常节律至少部分依赖于 mTORC1 活性的细胞自主昼夜节律调节,并通过节律性蛋白的产生、胞质和核/细胞器之间的蛋白质丰度差异来实现。
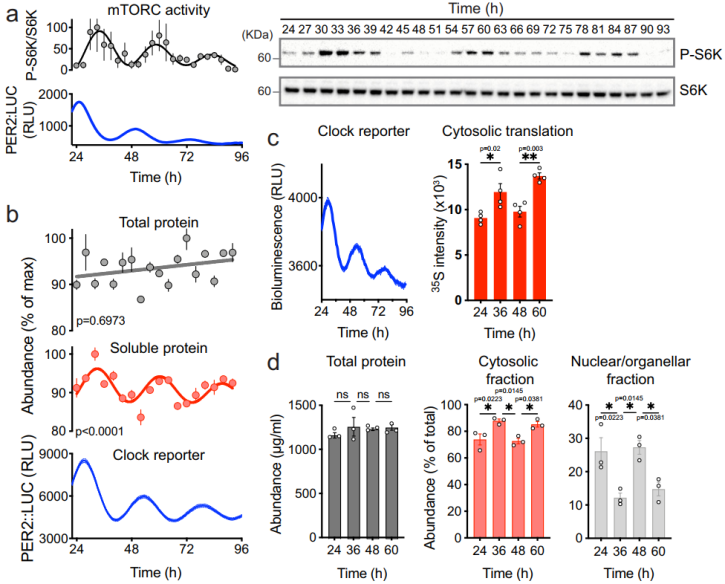
(图片来源:Nature Communications)
细胞内离子浓度与可溶性蛋白的反相振荡
大多数细胞对水具有很高的渗透性,因此在渗透激发下,细胞体积容易发生变化;而组织液稳态则需要确保细胞很少受到细胞外渗透压的急性干扰,保护细胞体积不受细胞内渗透压波动的影响。
实验数据表明,细胞体积没有相应的每日节律变化,这意味着细胞成功地缓冲了渗透势,以抵抗昼夜节律时间范围内细胞溶质蛋白浓度的变化。更为重要的是,他们观察到细胞内 K、Na 和 Cl 离子的 24 小时节律与可溶性蛋白质反相振荡,即当可溶性蛋白质增加时,K、Na 和 Cl 离子输出;当可溶性蛋白质减少时,K、Na 和 Cl 离子输入。
为了评估离子和胞浆蛋白的变化是否受细胞自主昼夜节律的调控,他们分析了生物钟被破坏小鼠的细胞,发现其表达的昼夜节律比野生型快,但可溶性蛋白质和离子丰度仍然存在反相振荡。这些数据表明,细胞自主的生物钟机制协调代偿性离子转运,以适应细胞溶质中蛋白质含量的每日节律变化,而不发生体积变化。
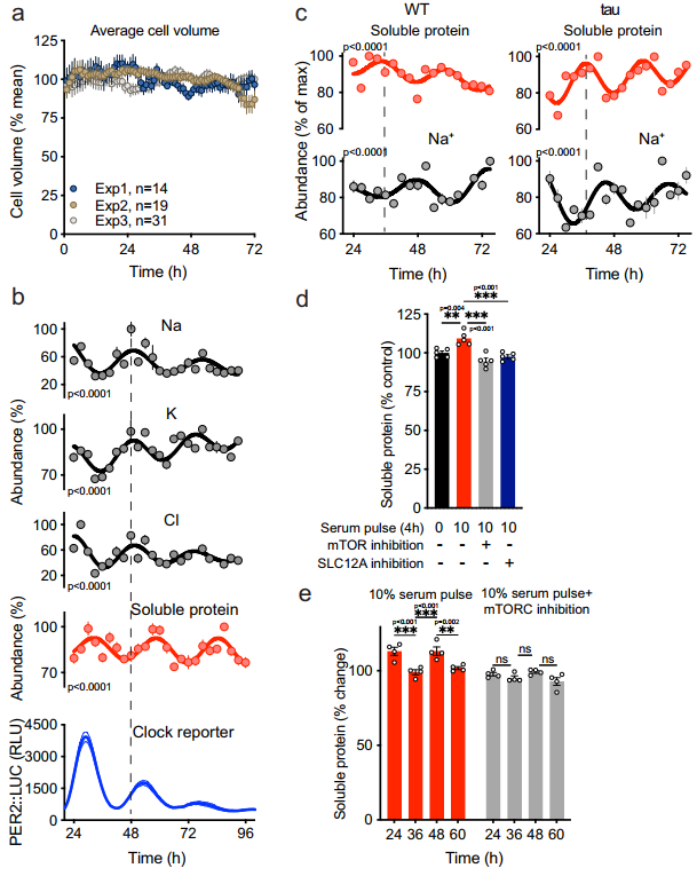
(图片来源:Nature Communications)
心肌细胞活动和心率的细胞自主节律
接下来,他们探索了细胞内离子含量每日节律的生理作用。由于 Na、K 和 Cl 离子的浓度及膜通透性决定了细胞静息电位和可兴奋细胞的电生理特性。因此,他们采用原代小鼠的新生心肌细胞作为模型,测试了细胞自主的昼夜节律调节离子丰度对细胞电活动的影响。与原代成纤维细胞一样,在心肌细胞内,Na、K 和 Cl 中仍然观察到了 24 小时的细胞自主节律。
为了评估这种节律在体内的相关性,他们在白天时,每隔 4 小时从成年小鼠身上采集整个心脏组织,并通过 ICP-MS 分析细胞内离子丰度。结果观察到细胞内钠和钾离子的丰度有显著变化,离子含量在休息时间结束时达到峰值,此时 mTORC 活性和可溶性蛋白通常较低。同时,在一天的时间变化中,当离子水平较高时,动作电位放电更频繁。
综上这些数据说明,心肌细胞电活动的细胞自主性、一天中的时间变化至少部分是由细胞离子含量与胞浆蛋白丰度的昼夜节律共同驱动的。
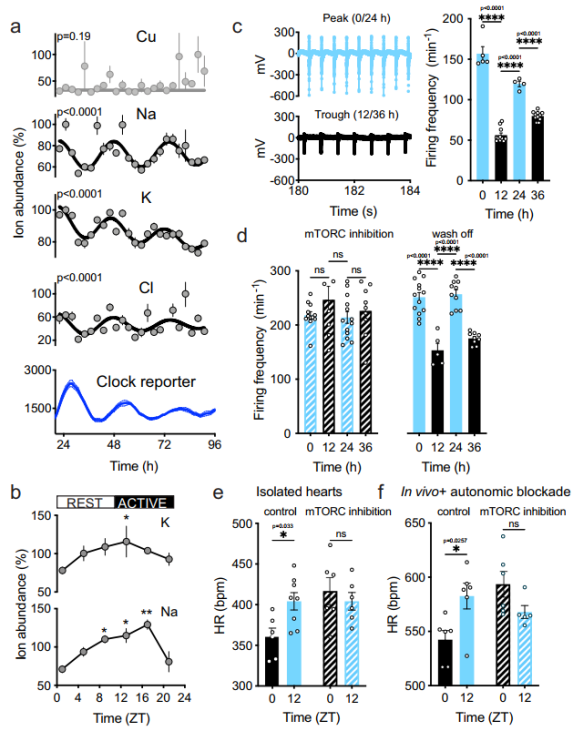
( 图片来源:Nature Communications)
综上所述,这些研究表明,离子和蛋白质丰度的相互调节是维持渗透稳态的细胞机制。通过在对应于离子节律峰谷的生物时间进行场电位记录,研究人员也发现了分离的心肌细胞的动作电位放电率在一天中的时间变化。同时,可溶性蛋白浓度可直接影响细胞内钠、钾离子含量,从而调节细胞电生理,这种基本的节律对电活性细胞(如心肌细胞)的生理学具有重要意义。
这项研究的结果也提示,当生活方式与身体内部生物钟相反时,如轮班工作、夜班工作或者熬夜等,可能会导致心脏细胞的内部昼夜节律与我们的行为脱钩,从而破坏心脏节律,而当昼夜节律不再规律时,这会增加不良事件的风险,如心律失常和心脏猝死。
本研究通讯作者,MRC 分子生物学实验室的 John O' Neill 博士说道:「许多危及生命的心脏问题发生在一天中的特定时间,更经常发生在轮班工人身上。我们认为,当心脏中的昼夜时钟与大脑中的时钟脱节时,就像轮班工作时一样,我们的心血管系统可能不太能够处理日常工作生活的压力。这可能使心脏更容易功能障碍。」
参考资料:
1.Stangherlin, A., Watson, J.L., Wong, D.C.S. et al. Compensatory ion transport buffers daily protein rhythms to regulate osmotic balance and cellular physiology. Nat Commun 12, 6035 (2021).
2.Hoyle, N. P. et al. Circadian actin dynamics drive rhythmic fibroblast mobilization during wound healing. Sci. Transl. Med. 9, eaal2774 (2017).
3.Feeney, K. A. et al. Daily magnesium fluxes regulate cellular timekeeping and energy balance. Nature 532, 375–379 (2016).







