肝硬化(晚期肝纤维化)是慢性肝脏疾病发展至晚期的共同结局,是肝脏相关死亡的主要原因。据统计,全球每年死于肝硬化的人数高达100多万。在中国,肝硬化的主要病因是慢性乙型肝炎,近年来酒精性及非酒精性脂肪性肝病所致肝硬化比例也逐渐增加。尽管当代医药技术突飞猛进,但目前尚无可以治愈肝硬化的药物,肝脏移植是治疗晚期肝硬化的唯一途径。然而,健康肝脏供应却严重短缺。寻找肝硬化新疗法迫在眉睫。
2021年1月25日,北卡罗来纳大学教堂山分校的黄力夫(Leaf Huang)教授团队在《Nature Nanotechnology》发布了一项题为Hepatic macrophages act as a central hub for relaxin-mediated alleviation of liver fibrosis的研究,利用脂质纳米粒搭载编码松弛素(relaxin,RLN)的质粒DNA以及微小RNA-30a-5p(miR-30a-5p),特异性靶向肝星状细胞(激活的肝星状细胞(activated hepatic stellate cell,aHSC)是造成肝纤维化的主要媒介细胞),在多种小鼠肝纤维化模型中有效遏制并逆转了纤维化发展,为肝硬化治疗带来曙光。

https://doi.org/10.1038/s41565-020-00836-6

论文通讯作者黄力夫教授(左)和第一作者胡梦莹博士(右)
RLN是20世纪初发现的在孕期分娩前大量分泌的对产道有松弛作用的多肽类激素。近年来,科学家发现RLN受体(RXFP1)在其他多种器官中均有表达,RLN与RXFP1结合可在这些组织器官内起到扩张血管、诱导细胞外基质降解以及逆转成纤维细胞激活的作用,从而抑制纤维化发展。然而,RLN的血液循环半衰期极短(约10分钟),经静脉注射后极少能到达靶器官发挥药效。
为解决此困境,研究人员将编码RLN的质粒DNA(pRLN)包载入脂质纳米粒中,利用脂质纳米粒自发富集于肝脏的性质将静脉注射后的基因药物递送至病变肝脏,实验结果证明,纤维化的小鼠肝脏成功化身“生物工厂”,经pRLN转染后表达大量RLN,且该表达仅限于病变肝脏,而不波及其他重要器官。在小鼠肝纤维化模型中,RLN基因疗法显著降低了HSC的激活及肝脏内胶原蛋白沉积。
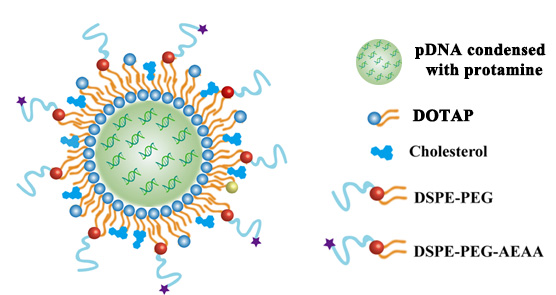
包载基因药物的脂质纳米粒示意图

pRLN选择性表达于纤维化肝脏
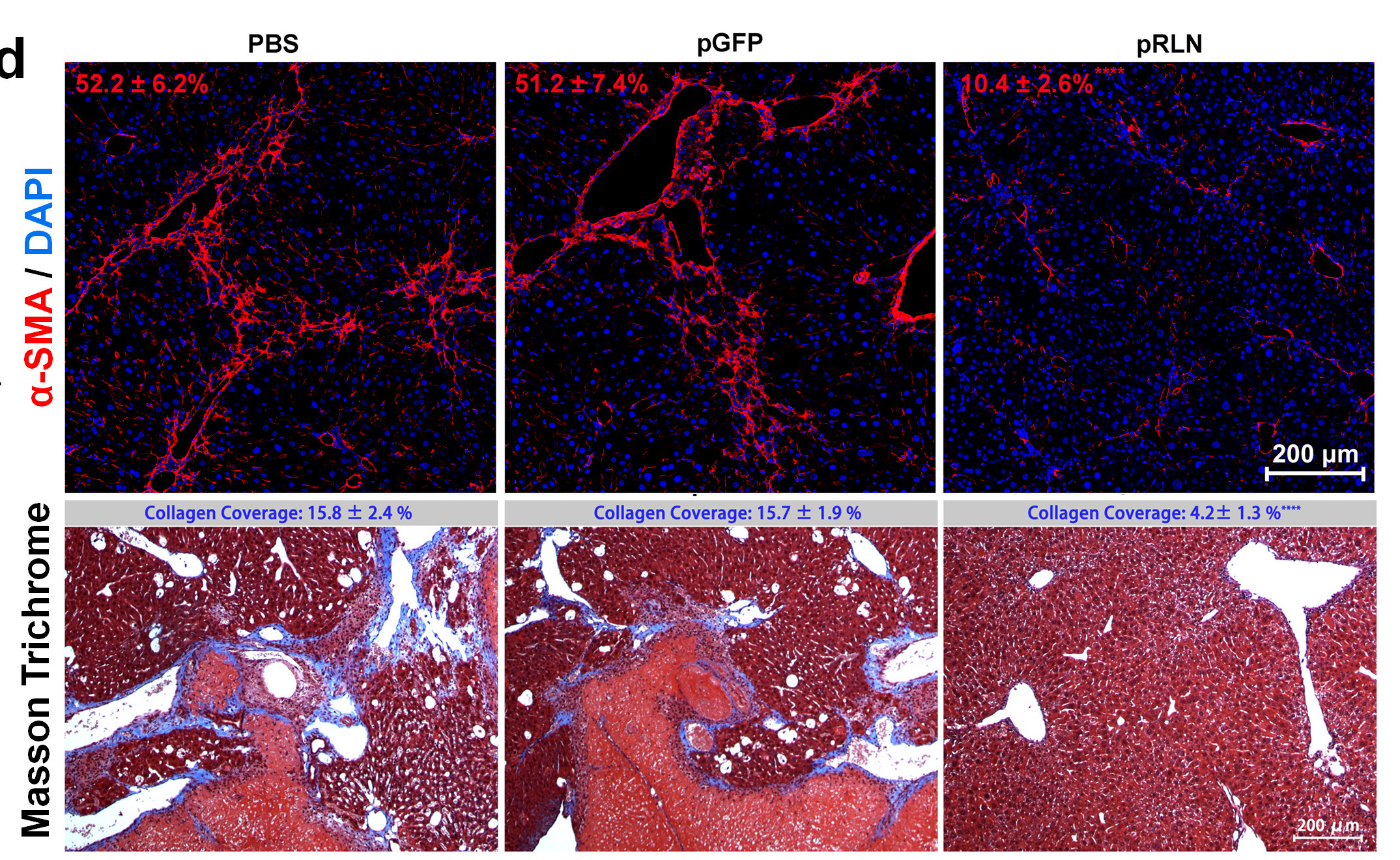
RLN基因治疗显著降低纤维化肝脏中HSC的激活以及胶原沉积
研究人员不仅证实了RLN对肝硬化治疗的有效性,更提出了巨噬细胞(Macrophage,MΦ)对RLN诱导肝星状细胞去激活起决定性作用。
论文的第一作者胡梦莹博士说:“aHSC大幅上调RXFP1早有报道,因此我们起初假设转录产生的RLN能够直接与aHSC表面的RXFP1结合,使其恢复至静息态。然而在实际操作中,却发现RLN体外处理aHSC对其表型没有影响。这种体内外结果的不一致性暗示RLN是间接影响aHSC,且这种影响很大概率是由aHSC周边环境介导的,之后我们发现纤维化肝脏中80-90%的MΦ表达RXFP1。”
肝MΦ对肝损伤的迅速应答起至关重要的作用。当肝脏受损时,Kupffer Cell(组织驻留型MΦ)会释放趋化因子(如CCL2,CCL5)从外周血招募大量循环单核细胞入肝,并诱导其分化为促炎型MΦ,从而激活HSC,导致肝炎、肝纤维化加剧。
事实上,目前大量抗肝纤维化研究专注于开发CCL2/CCL5阻断剂,从而抑制单核细胞衍生的MΦ聚集至肝脏。然而,单核细胞衍生的促炎型MΦ可进一步在特定环境信号诱导下极化获得抗纤维化表型,起抑制炎症和降解细胞外基质的作用,从而促进组织修复。因此,单纯阻断外周循环单核细胞衍生的MΦ招募也切断了此类“修复性MΦ”的源头,可能导致无法真正治愈肝硬化。
这项新研究反其道而行之,首次发现RLN基因治疗促进了CCL2/CCL5的释放,招募更多的单核细胞衍生的MΦ进入纤维化肝脏;同时,表达产生的RLN作用于这些MΦ促进其表型由促炎型向修复型转换。
除了指出RLN诱导MΦ表型极化,研究团队还发现经RLN刺激后的MΦ释放外泌体从而诱导aHSC恢复至静息态。
通过高通量测序筛选MΦ外泌体内具有差异表达的微小RNA,研究人员发现miR-30a-5p在RLN刺激后的MΦ产生的外泌体内表达升高,aHSC摄取miR-30a-5p后下调ASK1激酶,重新释放调节HSC激活态的PPAR-γ核受体,最终诱导aHSC去激活。根据这一新发现,研究团队设计了pRLN+miR-30a-5p联合基因疗法,在四氯化碳诱导的肝纤维化模型以及非酒精性脂肪肝炎模型中证实协同抑制炎症发展,逆转肝纤维化。
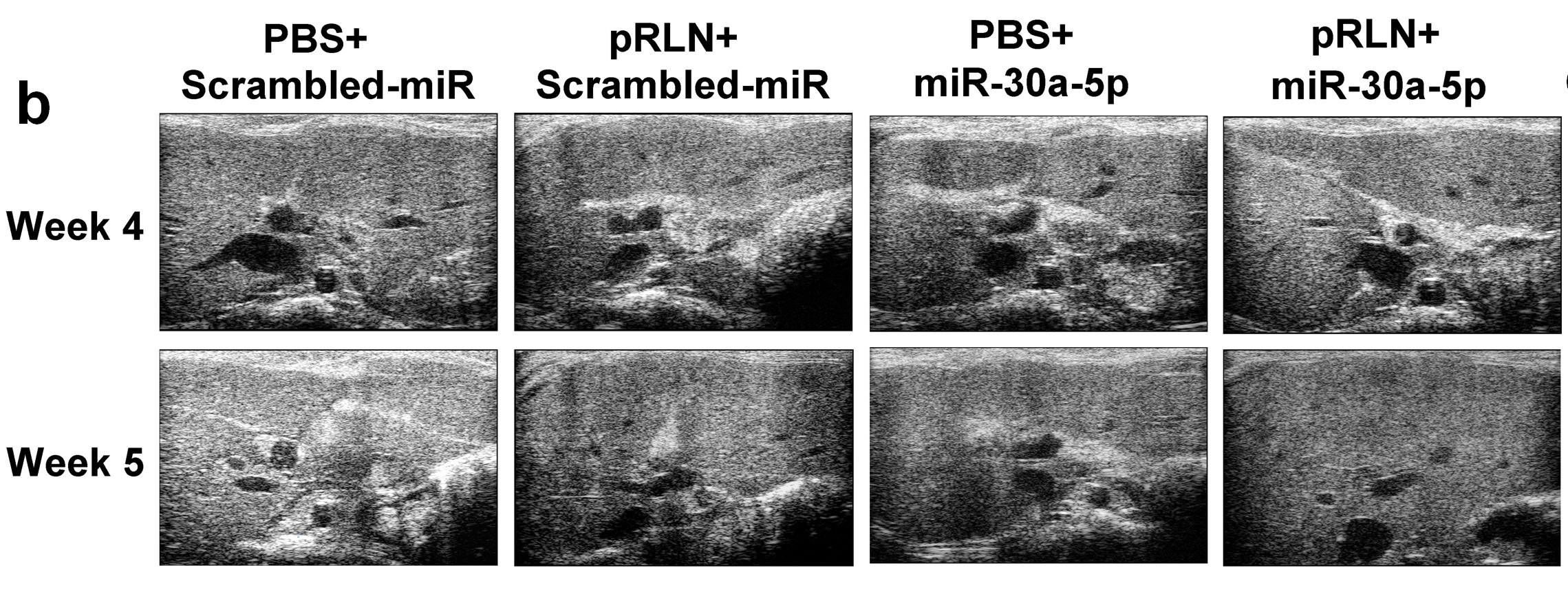
pRLN+miR-30a-5p联合基因疗法协同逆转肝纤维化
论文通讯作者黄力夫教授表示:“这是一篇非典型的Nature Nanotechnology文章,因为我们用来递送基因药物的脂质纳米粒已有十多年历史,这篇文章的亮点在于发现了一种新的抗纤维化生物机制。但值得注意的是,我们的所有发现始于体内外松弛素药效的差异性,如果没有纳米技术递送基因药物,我们并不会发现松弛素显著的抗纤维化效果,也就不会有接下去的故事。”
综上所述,pRLN基因疗法在病变肝脏大量制造松弛素,刺激肝MΦ向修复性表型极化并释放高表达miR-30a-5p的外泌体,抑制了肝脏炎症的发展,间接驱使HSC去激活,pRLN+miR-30a-5p联合基因疗法有望逆转中晚期肝纤维化。另外,该研究启示基础医学研究者们:纳米技术有望为生物新靶点的发现提供有力利器。