在2010年5月的Cell杂志上,刊登了一篇重要论文,这项研究成果是中法两国科研工作者结出的友谊之花。来自上海瑞金医院急诊科的青年医生叶静和她的法国研究团队在国际上首次证明了TRF2(端粒相关蛋白2,又被称为端粒盖帽保护蛋白)和Apollo(一种活性酶)参与端粒(染色体末端)复制,即保证DNA在复制中不出错的机理。该项基础研究的成果可能对许多危重疾病的诊治产生实际意义。
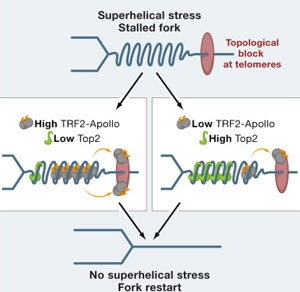
关于端粒和端粒酶的发现在2009年获得了诺贝尔医学奖,端粒的本质和染色体一样,都是DNA序列。近30年的相关研究表明,端粒和端粒酶同时与影响人类寿命的两大因素――肿瘤和衰老密切相关,同时还与氧化、应激有关。
参与此项研究的是上海瑞金医院中法生命科学和基因组研究中心和法国EricGilson研究组,EricGilson研究组是法国最强的端粒研究实验室,拥有欧洲至为著名的端粒研究中心,在全世界端粒研究领域享有很高声誉,两者具有长期合作的良好关系。叶静在法国攻读博士期间,与法方导师及研究人员在对蛋白与端粒相互结合深入研究的基础上,进一步证明TRF2确实在端粒复制中发挥重要作用,他们在国际上首次提出并阐明了TRF2通过调控Apollo的外切核酸酶活性,作为端粒保护核心蛋白,确保DNA复制过程中端粒结构和功能的完整。
该研究在基础领域和实践领域有着较为广阔的前景,它有助于早期控制急性氧化应激,联手控制急性应激损伤,减少细胞病理性损伤或脏器功能衰竭。从而对保护脏器功能、提高生存率和降低围手术期并发症等具有重要临床意义。
Cell杂志作为基础科学领域的权威杂志之一,在学术界有着极大的影响力。多年来,能在Cell上发表学术成果的中国科研工作者可谓凤毛麟角。叶静于上海第二医科大学内科学硕士毕业后一直在上海瑞金医院急诊科临床一线工作,并一直参与临床应用研究和基础科学研究,有着较为丰富的临床实践经验和科研能力。2006年起,叶静赴法国攻读上海交通大学医学院和法国巴黎高师里昂分院分子生物系联合培养博士学位。
上海瑞金医院急诊部主任、中法生命科学和基因组研究中心主任陆一鸣,也是这个研究项目的参与者之一,他表示,叶静回国之后,将在中法中心实验室继续这个课题的研究,同时希望中法科学家之间的良好合作能够更加深入。(生物谷Bioon.com)
生物谷推荐原文出处:
Cell doi:10.1016/j.cell.2010.05.032
TRF2 and Apollo Cooperate with Topoisomerase 2α to Protect Human Telomeres from Replicative Damage
Jing Ye, Christelle Lenain, Serge Bauwens, Angela Rizzo, Adela?de Saint-Léger, Ana?s Poulet, Delphine Benarroch, Frédérique Magdinier, Julia Morere, Simon Amiard, Els Verhoeyen, Sébastien Britton, Patrick Calsou, Bernard Salles, Anna Bizard, Marc Nadal, Erica Salvati, Laure Sabatier, Yunlin Wu, Annamaria Biroccio, Arturo Londo?o-Vallejo, Marie-Josèphe Giraud-Panis, Eric Gilson
Human telomeres are protected from DNA damage by a nucleoprotein complex that includes the repeat-binding factor TRF2. Here, we report that TRF2 regulates the 5 exonuclease activity of its binding partner, Apollo, a member of the metallo-β-lactamase family that is required for telomere integrity during S phase. TRF2 and Apollo also suppress damage to engineered interstitial telomere repeat tracts that were inserted far away from chromosome ends. Genetic data indicate that DNA topoisomerase 2α acts in the same pathway of telomere protection as TRF2 and Apollo. Moreover, TRF2, which binds preferentially to positively supercoiled DNA substrates, together with Apollo, negatively regulates the amount of TOP1, TOP2α, and TOP2β at telomeres. Our data are consistent with a model in which TRF2 and Apollo relieve topological stress during telomere replication. Our work also suggests that cellular senescence may be caused by topological problems that occur during the replication of the inner portion of telomeres.







