镰状细胞病是一种常见的遗传性疾病,全世界每年约有40万新生儿患有镰状细胞病。镰状血红蛋白(HbS)是正常成人血红蛋白(HbA)的一种变体,它是由红蛋白基因(HBB)含有单一的E6V错义突变而产生的。在脱氧过程中,HbS聚合,导致红细胞畸形,引发多种临床症状包括疼痛性脑血管破裂危象、慢性溶血性贫血、进行性和不可逆器官损害和早期死亡。目前镰状细胞病的标准治疗方法是异基因造血干细胞移植。超过90%的患者可以得到治愈,但存在包括严重移植物抗宿主病(GVHD)的风险以及可匹配的移植物缺乏等诸多局限性。
基础研究表明,高水平的由α-和γ-珠蛋白组成的红细胞-胎儿血红蛋白(HbF)可通过减轻镰状血红蛋白聚合和红细胞镰状化来改善这些症状。BCL11A是成人红细胞中γ珠蛋白表达和HbF产生的抑制因子,它的下调是诱导HbF的有潜力的治疗策略。
2020年12月5日,美国哈佛医学院David A. Williams团队在《NEJM》上在线发表了一篇题为“Post-Transcriptional Genetic Silencing of BCL11A to Treat Sickle Cell Disease”的文章,研究了BCL11A转录后基因沉默治疗镰状细胞病的疗效。

DOI: 10.1056/NEJMoa2029392
研究组进行了一项单中心、开放标签的先导研究,纳入镰状细胞病患者。在2018年2月至2020年3月期间,6名患者(入组时年龄7至25岁)接受了研究性基因治疗,随后接受了18个月的中位随访(范围7至29个月)。符合入选条件的镰状细胞病的严重表现包括卒中史(3例)、血管闭塞事件频发(2例)、阴茎异常勃起频繁等。
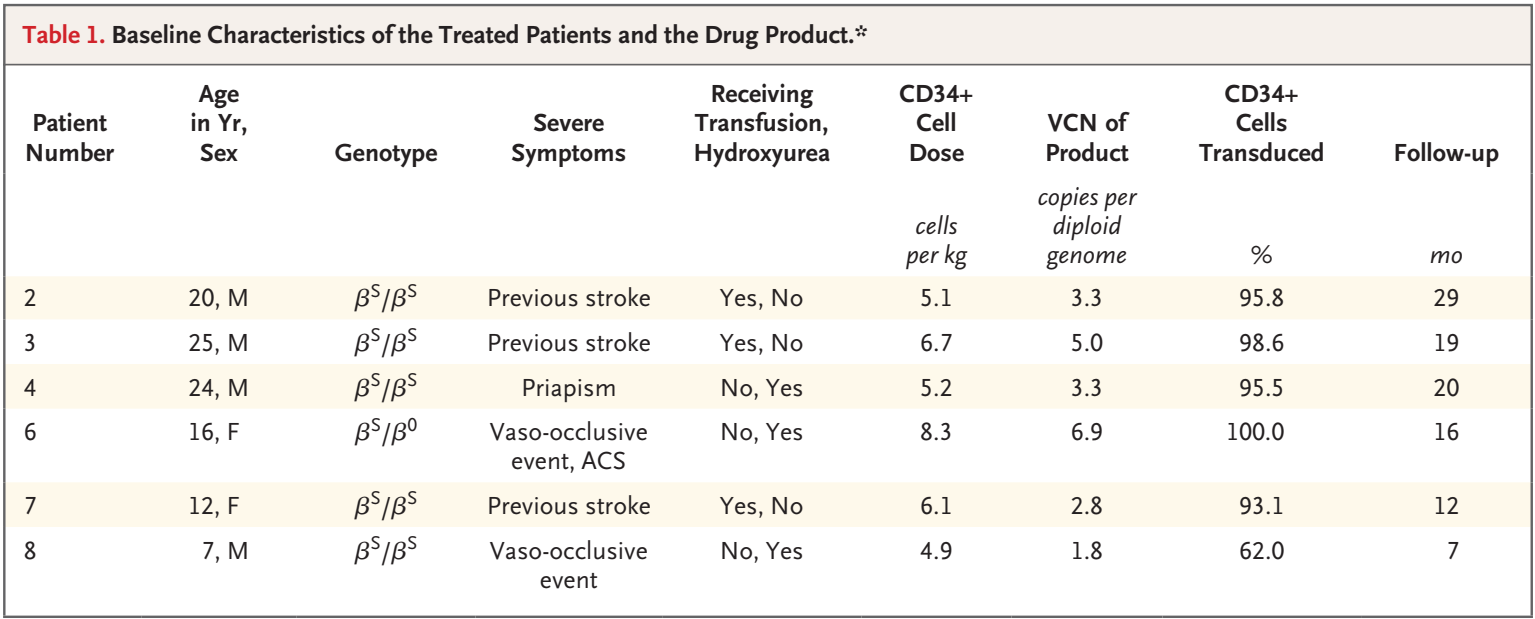
患者和治疗产品的基线特征
而在细胞方面,研究人员使用细胞分离平台(CliniMACS)选择CD34+细胞,用BCH-BB694 BCL11A shmiR慢病毒载体转导,低温保存。慢病毒载体编码一个短发夹状RNA(shRNA),靶向嵌在microRNA(shmiR) 中的BCL11A mRNA,允许红系特异性敲除。细胞转导在Dana-Farber细胞制造核心工厂进行。
患者连续4天接受静脉注射布舒凡进行充分的清髓调理,在最后一次注射布舒凡后至少24小时灌注转染的CD34+细胞。研究人员进行了2年随访,定期评估患者的不良事件以及镰状细胞病的临床和实验室标记物。主要结果为中性粒细胞计数,在输注后的7周内连续3天的绝对中性粒细胞计数至少为0.5×109 /升。次要结果包括转基因在不同细胞群体中的存在和功能,以及镰状细胞病的实验室和临床特征。
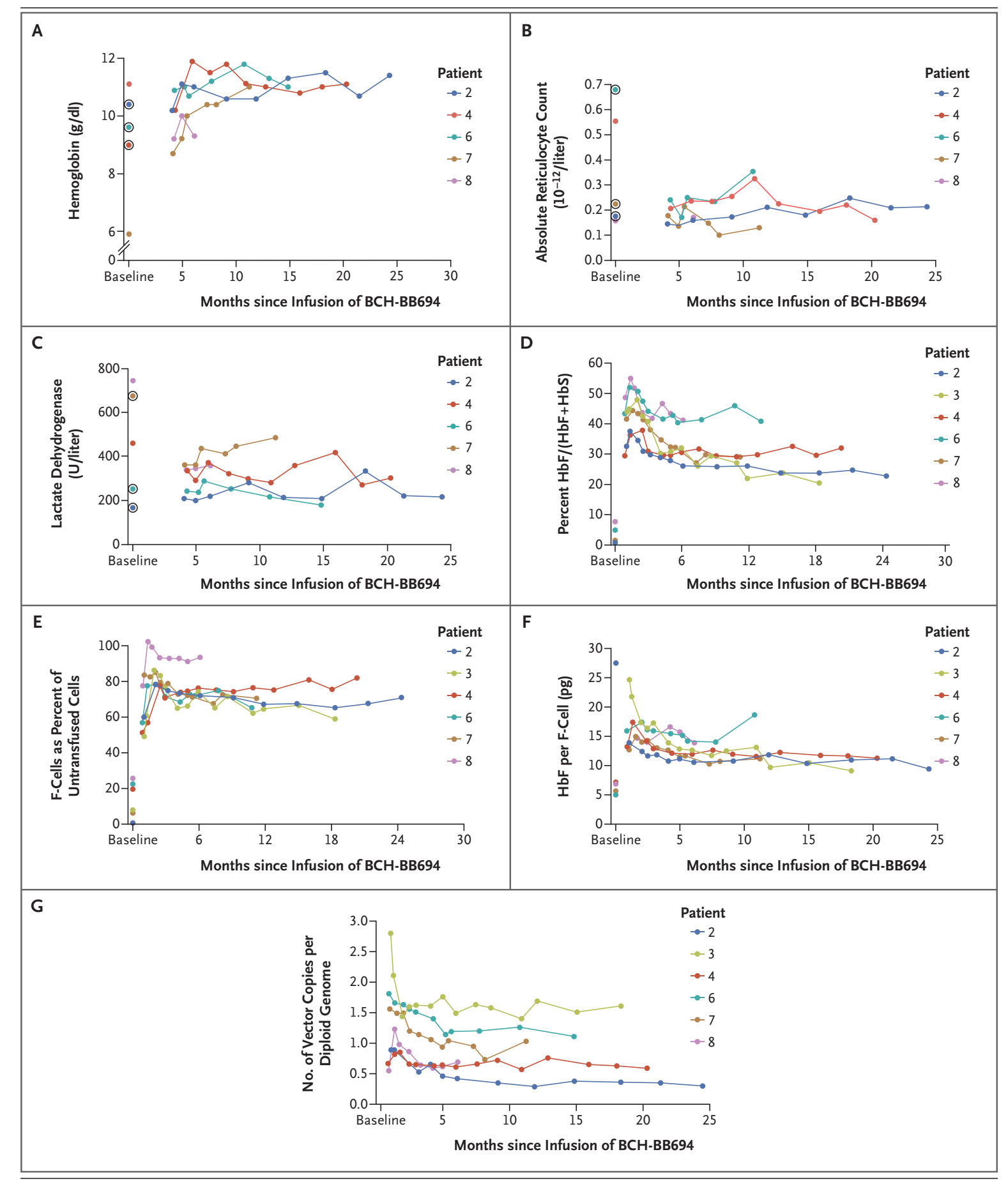
患者治疗期间各项指标的变化
结果表明,所有患者输注BCH-BB694 BCL11A shmiR药物后,红细胞-胎儿血红蛋白(HbF)在总血红蛋白中的比例均升高后保持稳定。随访期间,总HbF水平也趋于稳定。HbF的诱导广泛分布于红细胞。每个F-细胞的HbF为9.0-18.6 pg /细胞。在随访期间,患者镰状细胞病的临床表现减少或消失。
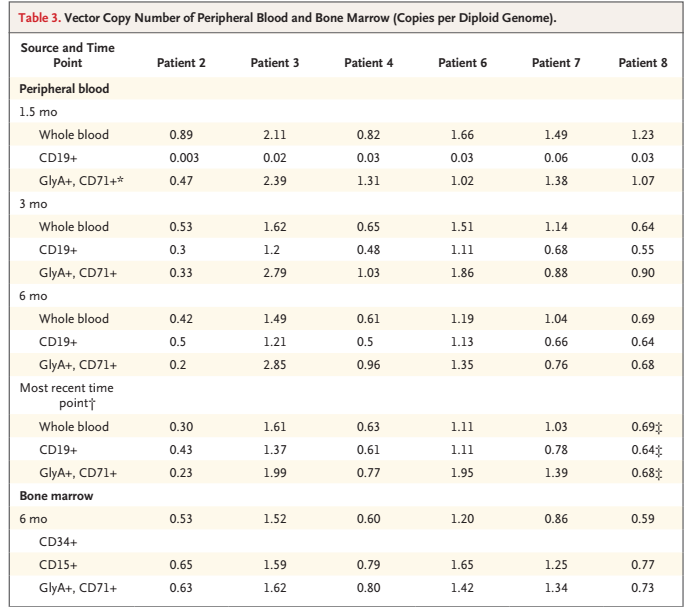
外周血和骨髓载体拷贝数
本篇研究报道了6例使用BCL11A治疗的严重镰状细胞病患者的研究结果,患者通过注射BCH-BB694 BCL11A shmiR转染CD34+细胞,这是一种逆转血红蛋白转换以增加细胞内HbF浓度并同时降低HbS的方法。截至2020年10月,这6名患者的随访时间均超过6个月,并实现了强有力的HbF诱导,且安全性良好。该研究证实了BCL11A抑制是HbF诱导的有效靶点,并初步证明基于shmiR的基因敲除在镰状细胞病中具有较好的临床获益。
参考资料:







