T淋巴细胞,是免疫细胞家族中的杀手,拥有“调节”或抑制免疫的能力。其细胞表面有数万亿独特的受体,可以识别并协助免疫系统杀死靶细胞,激活免疫系统的其他部分,并且保留以前细胞遇到的病原体的记忆,以备下次遇见时可以及时出击将其消灭。
T细胞有数十种亚型,均由胸腺中的血液干细胞形成。目前科学家已尝试通过增强T细胞抵抗癌症或感染的能力,或者降低自身免疫性疾病患者的T细胞活性,来作为治疗疾病的途径。如今大热的免疫疗法中的两大顶梁柱——PD-1/PD-L1抑制剂和CAR-T疗法都是以T细胞为基础而诞生的。
但是,由于干细胞依赖于胸腺的复杂化学信号,因此研究人员无法研究血干细胞如何分化为T细胞,在实验室培养皿或分离的干细胞中也无法轻易复制其分化的过程。
近日,来自美国加州大学洛杉矶分校再生医学与干细胞研究中心的研究人员在《Cell Reports》上发表了题为In Vitro Recapitulation of Murine Thymopoiesis from Single Hematopoietic StemCells的研究成果,其开发出一种无血清的3D鼠类人工胸腺类器官(M-ATO)系统,可以模仿正常鼠胸腺细胞生成,并且单个血干细胞就足以产生大量不同亚型和功能不同的小鼠T细胞。

https://doi.org/10.1016/j.celrep.2020.108320
研究人员之前成功开发了一种人工胸腺类器官(ATO)模型,用于从人造血干细胞和祖细胞(HSPC)以及人多能干细胞进行体外T细胞分化。由于某些类型的实验可能不能在人类而需要在小鼠中进行,因此研究人员通过调整培养所需的营养成分,改进先前开发的无血清ATO模型而开发出了小鼠人工胸腺类器官(M-ATO)系统。
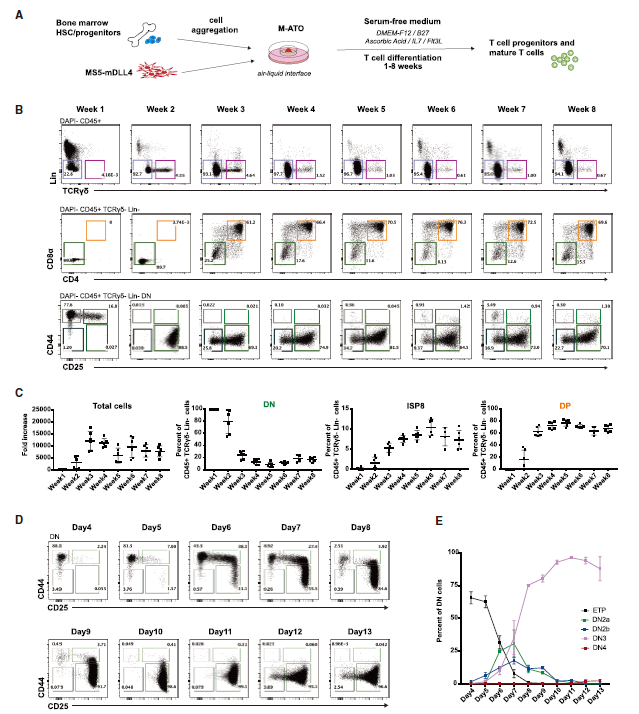
小鼠ATO中早期T细胞分化的动力学
检测发现,M-ATO在第2周时即可诱导HSPC对T细胞谱系的定向分化,而非T细胞谱系标记的细胞表达显著下降。在第2周和第3周之间,CD8 CD4双阴性(DN)细胞中开始出现未成熟的单阳性CD8 +(ISP8)和CD8 + CD4 +双阳性(DP)群体。对更成熟的T细胞进行分析,检测到CD3 + TCRb +细胞、包含CD4 + CD8 +(DP),CD4 CD8 +(CD8SP)和CD8CD4 +(CD4SP)成熟T细胞,及与先天T细胞一致的CD3 + CD4 CD8细胞群体,在第6周检测到具有Treg表型的细胞,并可长期维持。
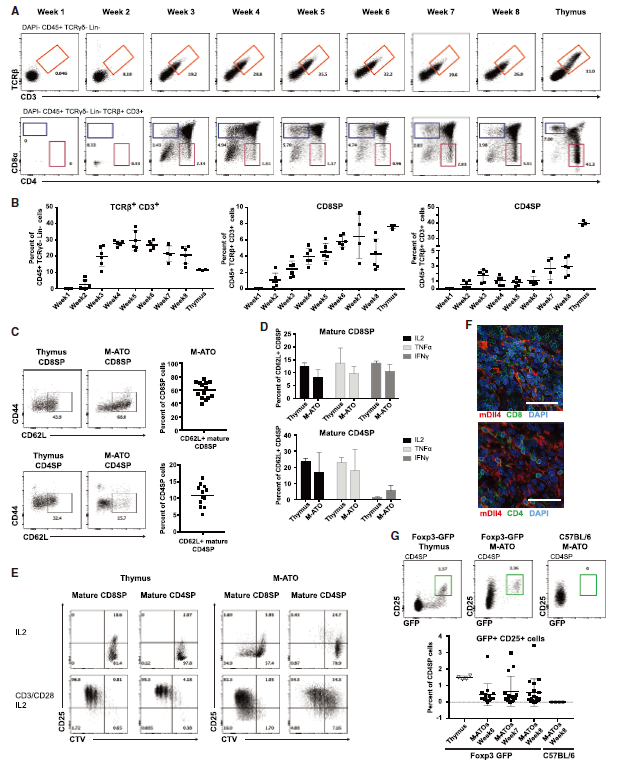
小鼠ATO产生功能性CD8SP和CD4SP成熟T细胞和Foxp3 + CD4 + Treg类细胞
之后,研究人员对M-ATO模型是否适用于其他鼠模型进行验证,比较了C57BL/6、C3H /He、BALB / c和FVB四种小鼠的M-ATO,发现在所有小鼠背景中,M-ATO都可进行有效的T细胞分化,其中C3H / He和FVB小鼠模型产生更多的CD4SP细胞,而在来自C57BL / 6和BALB / c的M-ATO中,CD8SP占比更多。对T细胞抗原受体(TCR)的多样性进行分析,表明四种不同的鼠类背景的M-ATO产生的CD8SP和CD4SP细胞均具有广泛的类型。
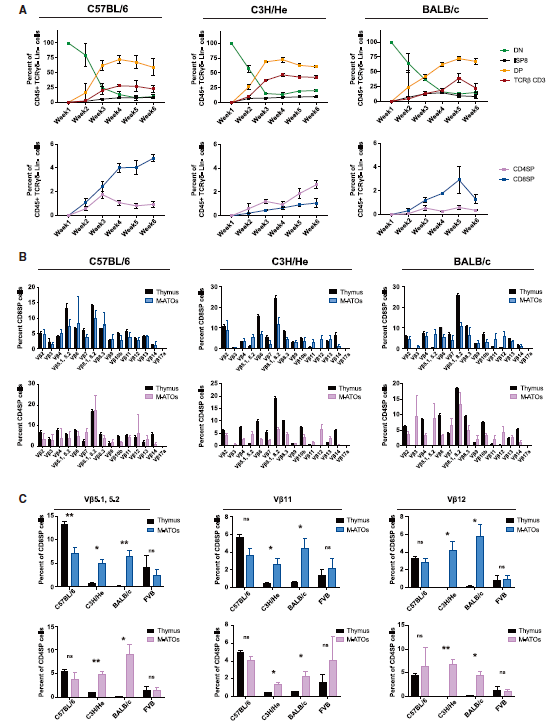
不同小鼠背景的M-ATOs中的T细胞分化和成熟
研究人员还对MATOs中T细胞分化的转录组和胸腺生成至关重要的信号通路进行分析和评估,发现M-ATO系统能反映原发性胸腺的表型和转录T细胞发育,以及 T细胞发育阶段中Notch报告基因活性的变化。对使用造血系统中不同的表型祖细胞而成的M-ATO系统是否能够概括T细胞发育进行研究,发现其具有不同的T细胞分化动力学。
该研究的通讯作者Gay M. Crooks说:“该M-ATO系统的新颖之处也在于,其可以从一个单一的干细胞开始,生成数百万个不同的T细胞。我们未来可以删除或改变被认为对产生T细胞重要的基因,使用该胸腺类器官来研究其对成熟T细胞的影响。”
参考资料:
In Vitro Recapitulation of Murine Thymopoiesis from Single Hematopoietic Stem Cells.







