我们在进化中选择了快速的伤口愈合方式,因而,在深层皮肤损伤之后,我们无法再生功能性真皮及其中的附件。有趣的是,全层切除皮肤伤口一些组织再生的能力,已经在小鼠中得到证明。长期以来,人们一直认为毛囊(HF)是伤口愈合过程中再生间充质细胞的潜在来源,然而,近期一项研究指出了成纤维细胞的再生潜能。
2020年8月4日,《Cell Stem Cell》杂志在线发表了加拿大卡尔加里大学Jeff Biernaskie小组题为“Distinct Regulatory Programs Control the Latent Regenerative Potential of Dermal Fibroblasts during Wound Healing”的研究,该研究表明,不同的调节程序着控制伤口愈合过程中皮肤成纤维细胞的再生潜能。

DOI:10.1016/j.stem.2020.07.008
研究人员使用绿色荧光标记hfDSCs,通过创伤诱导HF新生(WIHN)发现:尽管hfDSCs及其子代可以重新激活WIHN相关的转录程序,但它们不是皮肤伤口愈合和新生HF的主要动力。
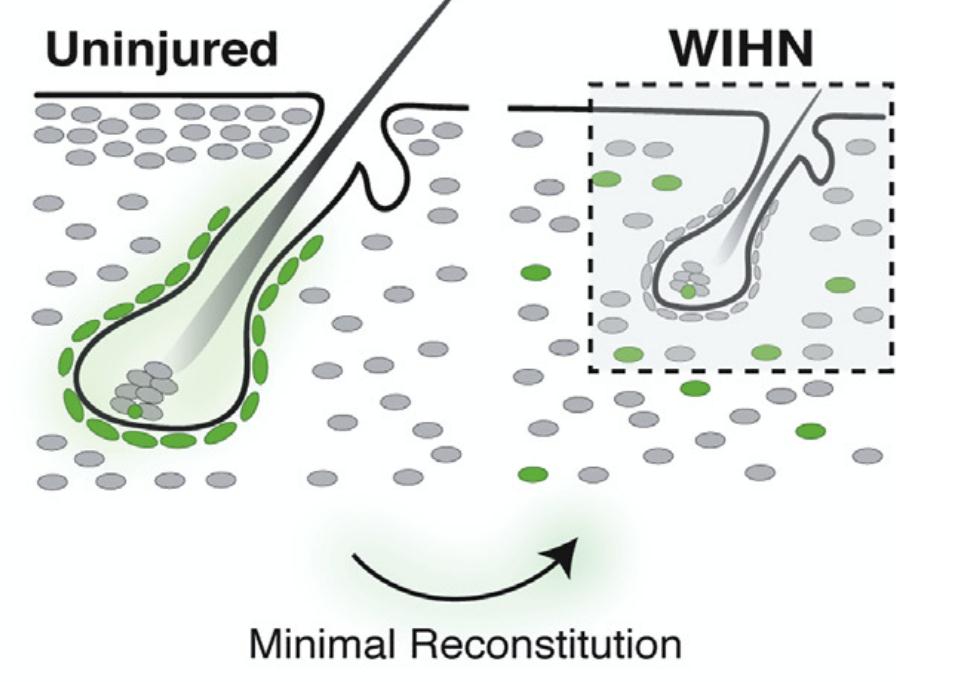
hfDSCs对新生HFs起到次要作用
由于hfDSCs对新生HF的作用不大,研究人员开始探讨其余再生间质的来源。他们推测Hic1(Hypermethylated in cancer 1)可能标记了成年哺乳动物皮肤中的间充质祖细胞(MP)。而且谱系追踪发现,hic1+细胞存在于血管周围的微环境中,并共同表达纤维脂肪生成MPs相关的标记物。同时,scRNA -seq也证实,Hic1谱系包括HF(8%)和HF外(73%)成纤维细胞。
因此,研究人员对Hic1+细胞也进行了荧光标记,结果显示,毛囊外Hic1:tdT+成纤维细胞对新生真皮起重要作用,并且在新生HF中诱导性间充质的重构超过90%,介导伤口新生真皮中心的再生和周围瘢痕的形成。
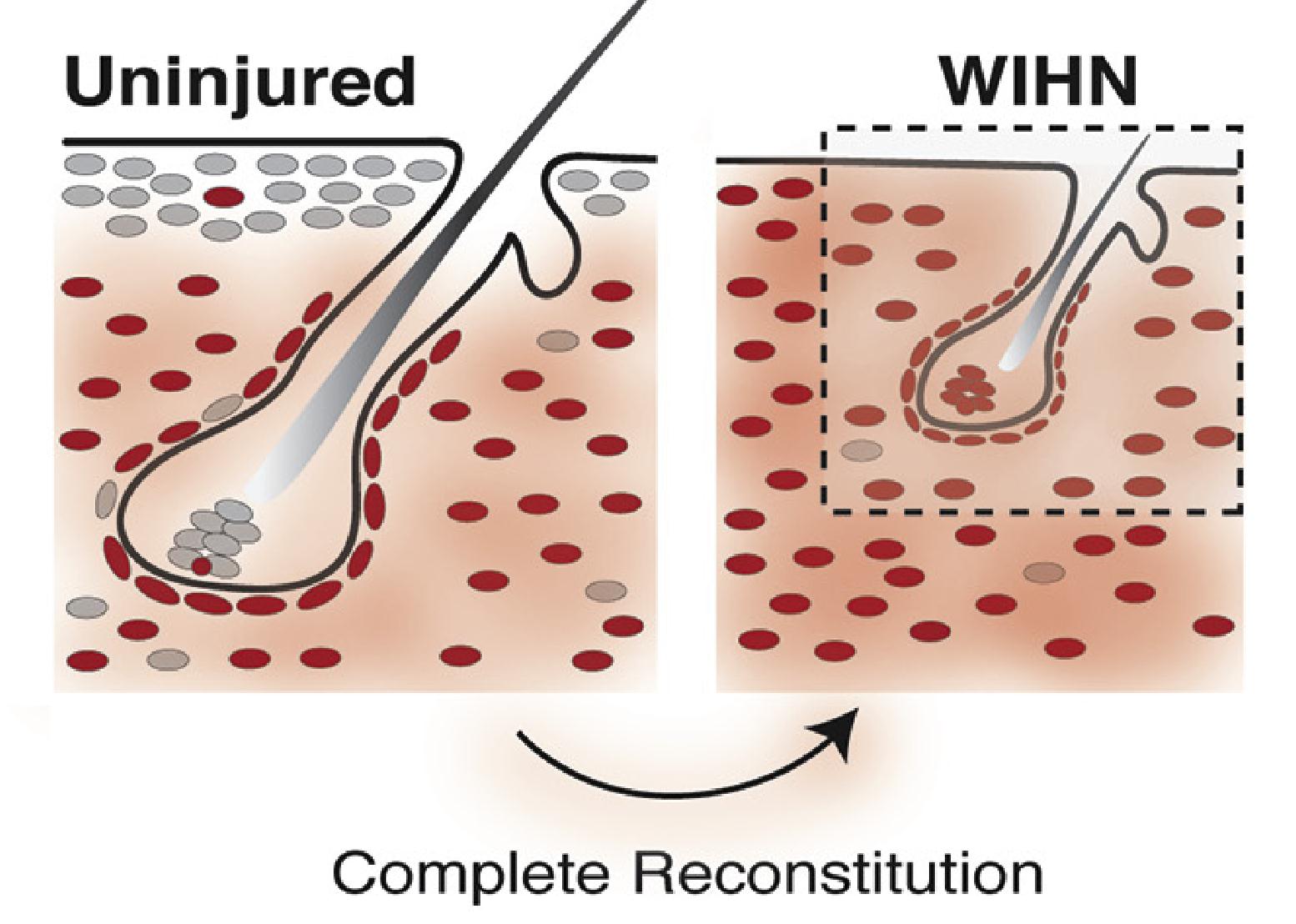
Hic1系祖细胞对新生HFs起到主要作用
单细胞转录组学显示,大伤口(LW)伤后14天(dpw)成纤维细胞出现胚胎真皮相关基因的总体富集。并且研究人员发现,大伤口中心区域(LWC)成纤维细胞优先表达细胞类视黄素结合蛋白和Runx1,而LW外周区域(LWP)成纤维细胞则表达瘢痕相关标志物; Crabp1+/ Prss35 +成纤维细胞位于大伤口中心区域的上表浅新生真皮内,在深部新真皮则完全不存在。这些差异表明成纤维细胞的空间隔离及其与上层表皮基底细胞的相互作用对再生能力的获得十分重要。
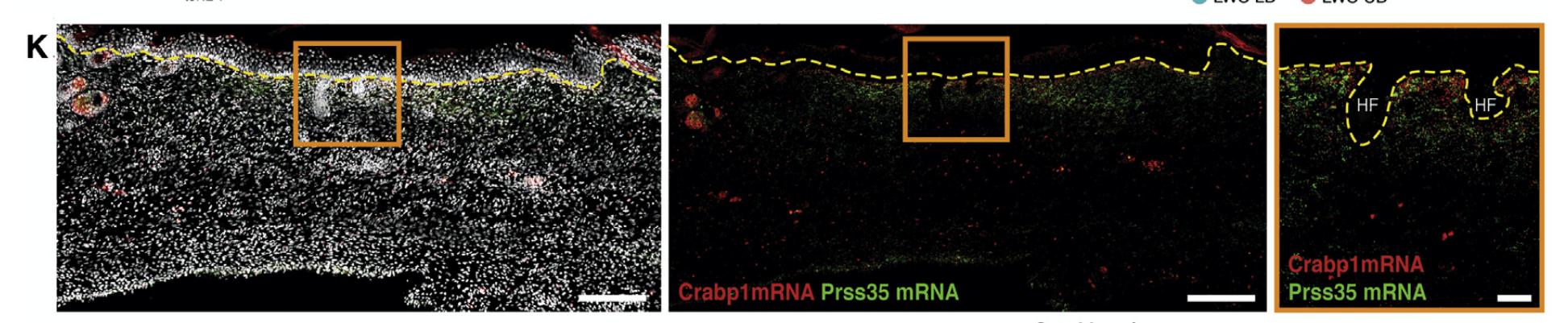
Prss35 +成纤维细胞分布于LWC表浅新生真皮内
研究人员对来自LWs、SWs和未损伤皮肤的Hic1系成纤维细胞进行单细胞转录组学进行单细胞调控网络的推理和聚类(SCENIC)分析后发现,多种转录因子在LWC和LWP成纤维细胞表达的水平相当,但在LWC成纤维细胞中更为活跃。

LWC与LWP成纤维细胞聚类
进一步分析发现,这些基因调控网络(GRN)使成纤维细胞展现诱导创伤后毛囊新生或者促进疤痕形成的能力。区域化成纤维细胞可塑性可能(至少部分)是由转录后或表观遗传机制驱动的。

伤口愈合过程中的药理调节
为了验证通过多组学分析鉴定得到的调节剂,研究人员选择了视黄酸(RA)和Runx1进行验证。结果表明, RA和Runx1抑制可改善再生潜能,与其假定作用相一致。也就是说,LWs的间充质成纤维细胞具有高度可塑性,它们不仅在损伤后出现基因组和表型改变,而且这种活动可以通过药物来调节。同时,实验表明Hic1的缺失通过增加LWs再生区域的成纤维细胞密度而增强WIHN。
因此研究人员认为,Hic1缺陷本身并不会使成纤维细胞产生亲纤维化反应。在伤口愈合过程中,调节Hic1可以更有效地调动皮肤MPs,并提供一个促进再生的伤口微环境。这可能是一种提高伤口愈合效果的可行方法。
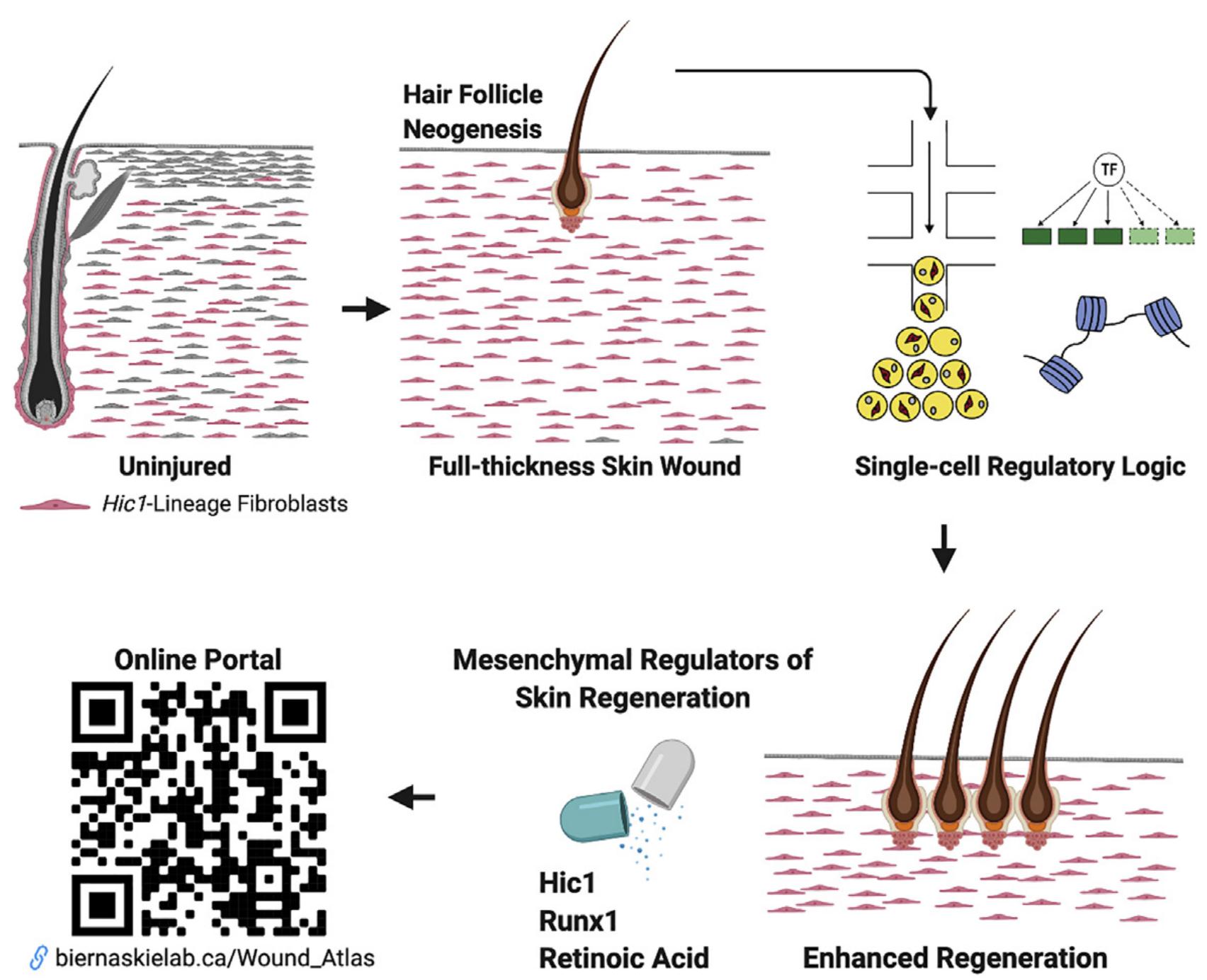
不同的调节程序控制伤口愈合过程中皮肤成纤维细胞的再生潜能
总而言之,在适合的环境中,动员来自Hic1+MPs的毛囊外成纤维细胞能够获得诱导性间充质细胞,参与HF新生。这些研究阐述了一种潜在的干预措施及分子靶点,未来或可在利用这种潜在的再生能力,并最终改善伤口愈合结果。
参考文献:







