
如今,阿尔茨海默症(AD)已成为全球公共卫生和社会难题。数据表明,每隔3秒,世界上就会多一位AD患者。截至2018年,全球AD患者总数已经超过5000万,而到2050年,这个数字预计将超过1.5亿。在早期阶段,AD的特征是大脑中淀粉样蛋白β(Aβ)和tau蛋白的聚集和记忆力减退。然而,目前通过靶向β-淀粉样蛋白或者加工淀粉样前体蛋白(APP)的疗法效果并不理想。因此,科学家将疾病机理和治疗发展的探索集中在了tau蛋白上。
7月29日,澳大利亚悉尼麦格理大学痴呆症研究中心的Arne Ittner教授和Lars Ittner教授两兄弟进行的一项研究表明:通过一种基因疗法——向神经元传递tau激酶p38γ的活性形式,可以改善已经出现明显记忆缺陷的AD模型小鼠的认知度。相关研究成果发表于《Acta Neuropathologica》上。

https://doi.org/10.1007/s00401-020-02191-1
研究小组先前已经证明,通过将遗传物质引入患病小鼠的细胞中,可以激活tau激酶p38γ,而这种酶被激活后,可以预防阿尔茨海默症的发展,他们的最新研究正是基于此。
具体来说,在本研究中,研究人员旨在确定增加神经元p38γ活性是否具有改善现有记忆缺陷的治疗潜力。他们发现,通过增加在tau中靶向T205的突触后激酶p38γ的活性,会减少有症状的Aβ诱导的AD模型的记忆缺陷。随后,研究人员用野生型人tau蛋白或磷酸化缺陷的tau T205A进行了重建实验,结果表明,T205修饰对于p38γ的下游效应至关重要,该下游效应阻止了APP转基因小鼠的记忆力损伤。
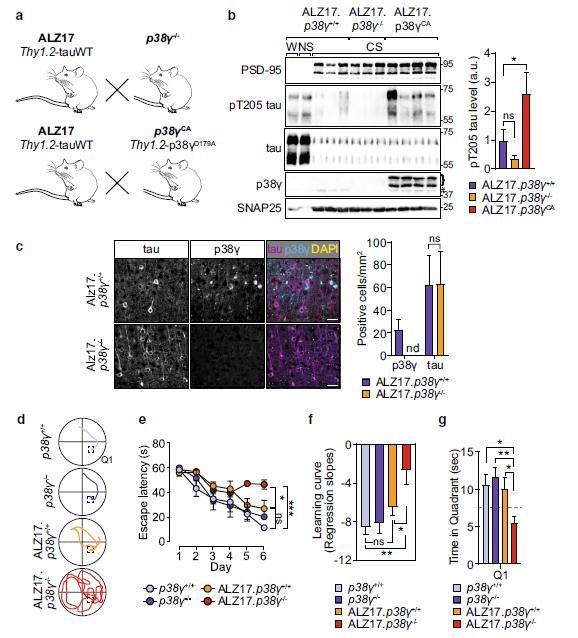
Tau毒性受内源性p38γ和T205磷酸化水平的调节
此外,对鼠Mapt基因中T205密码子的基因编辑结果显示,内源性tau蛋白的单侧链是调节转基因APP阿尔茨海默症小鼠记忆力不足的关键。研究人员还发现,在不表达人类致病性tau蛋白的转基因小鼠模型中,通过p38γ基因缺失消除了p38γ的保护作用后, tau蛋白具有了毒性,并在缺乏人Aβ的情况下会导致记忆功能受损。
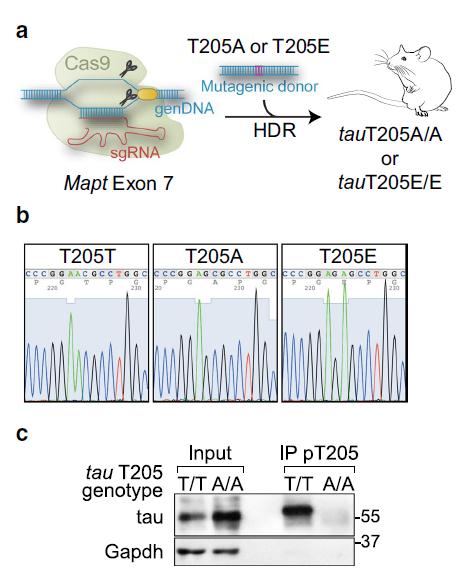
T205磷酸化位点的Mapt密码子的CRISPR / Cas9编辑
综合这些研究结果表明,调节p38γ活性可以作为内在的tau蛋白依赖性治疗方法,以改善晚期阿尔茨海默症的认知功能受损。
作者表示,这种基因疗法或许能用于治疗其他形式的痴呆症,例如额颞叶痴呆(通常会影响年轻人)。研究发现,即使在长时间接受高剂量治疗的情况下,也没有小鼠不良事件的发生,因此研究小组正在计划在人体中试用这种疗法。
为了解阿尔茨海默症的机理已经进行了数十年的基础研究,如果这种疗法在临床试验中奏效,那将会是万千阿尔茨海默症患者的福音。
参考资料:
Reduction of advanced tau‑mediated memory deficits by the MAP kinase p38γ







