
p53是体细胞中一种重要的抑癌基因。在正常情况下,p53是细胞分裂的“监视器”,它会根据细胞中DNA的变异程度,来决定是修复细胞还是将其“毁灭”。但如果“监视器”出现突变,就会失去这种监控能力,致使细胞分裂失去控制,从而导致细胞癌变。
然而,最近科学家的一项新发现打破了对突变型p53的常规认知。7月29日,来自以色列希伯来大学哈达萨医学院的研究人员在《Nature》上发表研究:突变型p53在远端肠中具有致癌作用,而在近端肠中具有抑癌作用,这种“双模式”是由肠道微生物决定的。

https://doi.org/10.1038/s41586-020-2541-0
具体来说,研究人员构建了两种p53突变的肠癌小鼠模型,已知在这些模型中,p53的缺失会促进癌症的发展。他们发现,在模型小鼠的近端肠道中未见侵袭或过度增殖的迹象,但远端肠道中出现了高度异常增生和增殖。这些数据表明,在近端肠道中,突变型p53推翻了原本促癌作用的认知,并减弱了模型小鼠的轻度增生和发育异常表型。值得注意的是,在抑癌模式下,突变型p53的肿瘤抑制作用比野生型p53更有效。
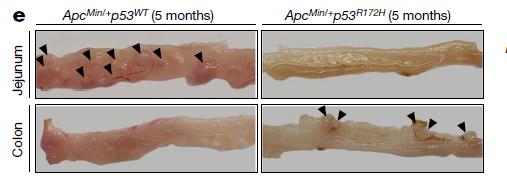
小鼠肠不同节段的代表性图像
那么,突变型p53肿瘤抑制作用的机制是什么呢?野生型p53对一组基因的表达具有抑制作用,这组基因被称为“p53抑制的侵袭性信号(PSIS)”。PSIS基因与多种侵袭性功能相关,其中许多基因是WNT信号通路的靶标。研究人员发现,突变型p53能够阻止肠道上皮中主要T细胞因子TCF4与染色质的结合,从而阻断WNT途径。
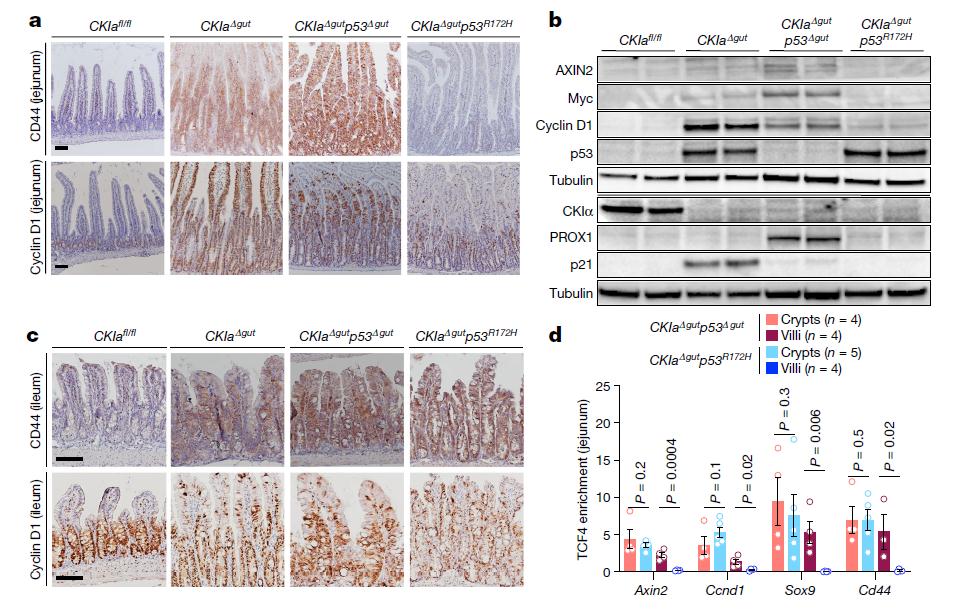
突变型p53可抑制WNT靶标在近端肠道中的表达
突变型p53为何会从致癌模式转变为抑癌模式呢?研究人员用抗生素混合物消除小鼠肠道菌群后发现,抗生素治疗消除了在结肠和回肠中观察到的不典型增生,而且根除肠道菌群也会导致WNT激活减少。这表明,肠道菌群会阻碍突变型p53对WNT的抑制,从而促进远端肠癌的发生。
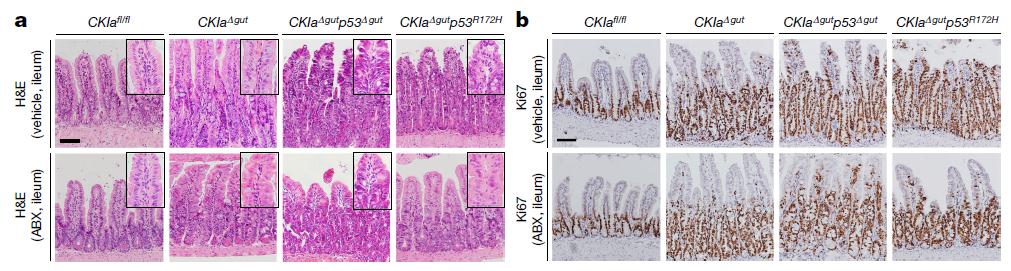
抗生素治疗可以在远端肠道中释放突变型p53的肿瘤抑制作用
那么,肠道菌群中的什么物质发挥了这种阻碍作用呢?研究人员发现,源自肠道菌群的单一代谢物——没食子酸可以完全再现肠道微生物组对于突变型p53的全部作用。用没食子酸补充经肠道灭菌的p53突变小鼠和p53突变类器官(三维细胞培养物),可以恢复TCF4-染色质相互作用以及WNT的过度活化,从而促进了类器官和整个肠道恶性表型的形成。
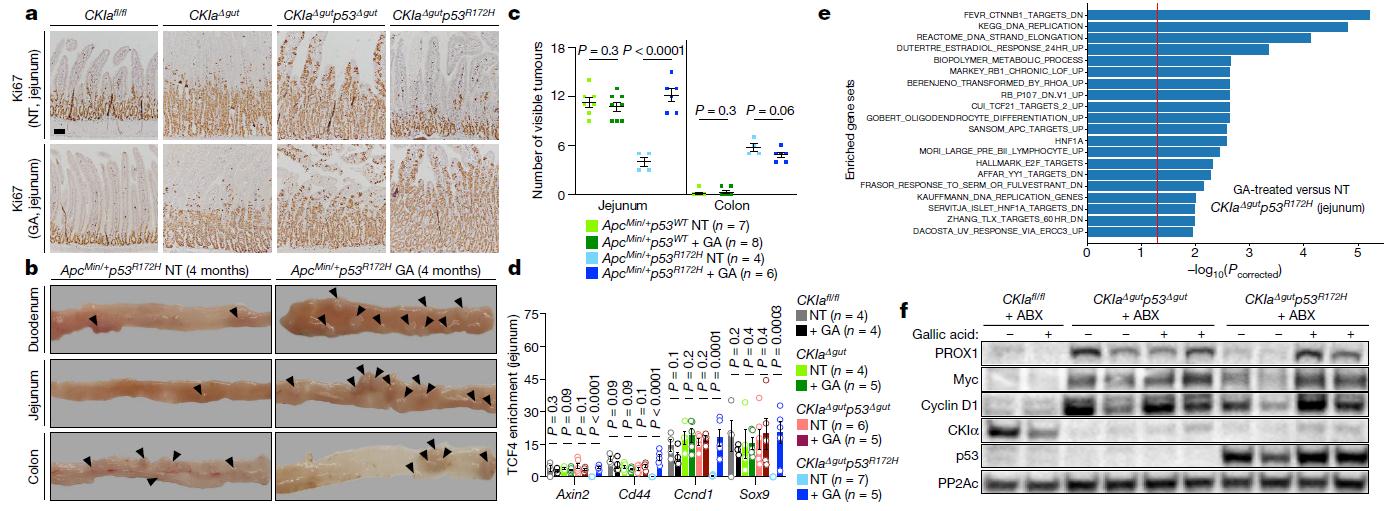
当p53突变时,没食子酸会诱导WNT驱动的发育异常和肿瘤发生。
研究人员强调,虽然没食子酸如何克服突变型p53的WNT阻断作用仍然未知,但是其可逆作用为癌症提供了可能的预防和治疗选择。例如,通过饮食管理、没食子酸合成抑制剂或拮抗剂使突变型p53发挥“正面作用”。同时,这项研究也给了一个信号:其他微生物来源的代谢物也可能充当突变型p53的类似调节剂,或者通过肿瘤基质和免疫系统有一些间接代谢物作用。
参考资料:







