“癌症之王”胰腺癌,一般发现较晚,进展速度快,患者死亡率高,在所有消化道肿瘤中预后最差。胰腺癌在免疫学上属于“冷”肿瘤,T细胞浸润稀疏,产生中等范围的新抗原。如何选择合适的治疗策略,怎样提高患者生存率,一直是医学专家面临的难题。
免疫检查点抑制剂疗法在2018年获得诺贝尔生理学或医学奖,正在逐渐的改变癌症治疗格局。尽管其已在多种癌症治疗中取得成功,但作为单药治疗胰腺癌的疗效并不理想。有研究发现,靶向CTLA-4、PD-1、PD-L1的治疗可以对抗免疫抑制,但不能使胰腺癌细胞死亡。
细胞自噬是真核生物中存在的一种高度保守的降解过程。在能量匮乏、活性氧累积等胁迫压力下,细胞会形成双层膜结构的自噬小体,然后送入溶酶体(动物)或液泡(酵母和植物)中进行降解并重新利用,以保证细胞的存活。在2016年获得诺贝尔生理学或医学奖。
免疫检查和细胞自噬本身是两个交集不大的研究领域,这次因为胰腺癌研究,结合到了一起。4月22日,哈佛大学、剑桥大学等多个顶尖科研机构合作,在Nature发表“Autophagy promotes immune evasion of pancreatic cancer by degrading MHC-I”的重磅研究结果。发现自噬通过降解主要组织相容性复合物(MHC-1)促进胰腺癌的免疫逃逸。通过抑制自噬和双靶点免疫检测点,可作为胰腺癌治疗的新思路。
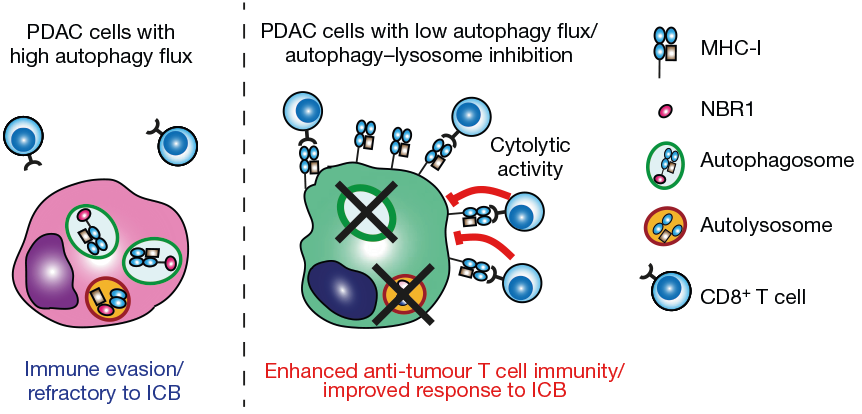
文章以胰腺导管腺癌(PDAC)为研究对象,揭示癌症治疗的主要障碍-免疫逃逸机制。免疫逃逸常见的机制包括MHC-1突变引起的抗原呈递受损,这与免疫检查点抑制剂治疗的耐药性相关。在本次研究中,发现PDAC细胞中,MHC-1分子通过自噬受体NBR1的自噬依赖性机制,被溶酶体选择性靶向降解。MHC-1的表达显著降低,且主要定位在自噬体和溶酶体中。
进一步研究发现,抑制自噬能够增强抗肿瘤免疫力。CD8+细胞毒性T细胞在抗肿瘤免疫中起重要作用。肿瘤特异性的自噬抑制导致抗原提呈增加,从而在体外增强CD8+ T细胞的增殖、激活和肿瘤细胞杀伤。抑制自噬能够显著恢复PDAC细胞表面MHC-1的表达水平,增强体内抗肿瘤T细胞的反应,抑制胰腺癌小鼠模型的肿瘤生长。
研究结果表明自噬是PDAC细胞免疫原性的关键决定因素。肿瘤特异性自噬抑制使PDAC肿瘤对双免疫检查点抑制剂(抗PD-1和抗CTLA4抗体)敏感。值得注意的是,氯喹和双免疫检查点抑制剂的结合发挥强大的抗肿瘤效果。联合治疗的肿瘤中CD8+ T细胞浸润增加,功能性PD1+TIM3-CD8+ T细胞数量增加。
综上所述,自噬抑制,再与双免疫检查点抑制剂(抗PD-1和抗CTLA4抗体)联用,能够线束增强抗肿瘤免疫反应,为胰腺癌治疗新策略提供理论依据。
世卫组织负责人谭塞德明确表示“新冠病毒将长期存在”,防疫进入常态化,复工复研也是迫在眉睫。为了让您在复工之后,仍能花费更少,发现更多的肿瘤机制,义翘神州特推出科研蛋白产品五折优惠活动。这次的活动不仅包含十几种新冠病毒的S蛋白、N蛋白,还有大量的热门靶点蛋白、FC受体蛋白。在大包装方面(比如1mg)会有更加超值的惊喜。扫描图中二维码了解详情。

活动时间:4月8日-6月30日
活动规则:
1. 每个课题组同一货号商品限购5支,同一课题组成员不累计参与活动;
2. 本活动不与其他活动以及其他优惠同时进行;
3. 活动商品:详见活动商品列表;
4. 本活动最终解释权归北京义翘神州科技股份有限公司所有。







