首先需要说一下“炎症小体”是个什么?炎症小体的代表是NLRP3炎症小体,由细胞内的NOD样受体、ASC和蛋白剪切酶caspase-1组成的多聚蛋白复合物。当受到外界刺激时,NOD样受体感知外界信号,诱导炎症小体复合体组装活化,激活caspase-1。caspase-1可以剪切炎性细胞因子IL-1β和IL-18,使其活化释放,介导炎症反应,清除病原微生物;caspase-1还能够剪切GSDMD,使其活化,诱导细胞膜穿孔,介导细胞焦亡。
在今年4月份的一期Nature期刊上,曾有四篇文章同期报道炎症小体的研究进展。其中两篇与NLRP1B炎症小体的活化机制有关,另外两篇是植物抗病小体在抑制状态,中间状态和活化状态时冷冻电镜结构。在近期的Nature杂志上又发表了一篇炎症小体有关的文章,研究与阿尔茨海默病(AD)有关。
早期研究发现脑部β淀粉样蛋白大量积累会导致NLRP3炎症小体活化,诱导神经炎症和阿尔茨海默病发生。在本次研究中,研究人员发现,额颞叶痴呆病人皮质中大量表达caspase-1和炎性细胞因子IL-1β。通过小鼠模型验证,发现tau蛋白突变,小鼠逐渐发展成为额颞叶痴呆病的过程中,炎症小体的活化也逐渐增强。这表明在tau蛋白病发展过程中会诱导炎症小体活化,说明tau病变和NLRP3炎症小体活化密切相关。
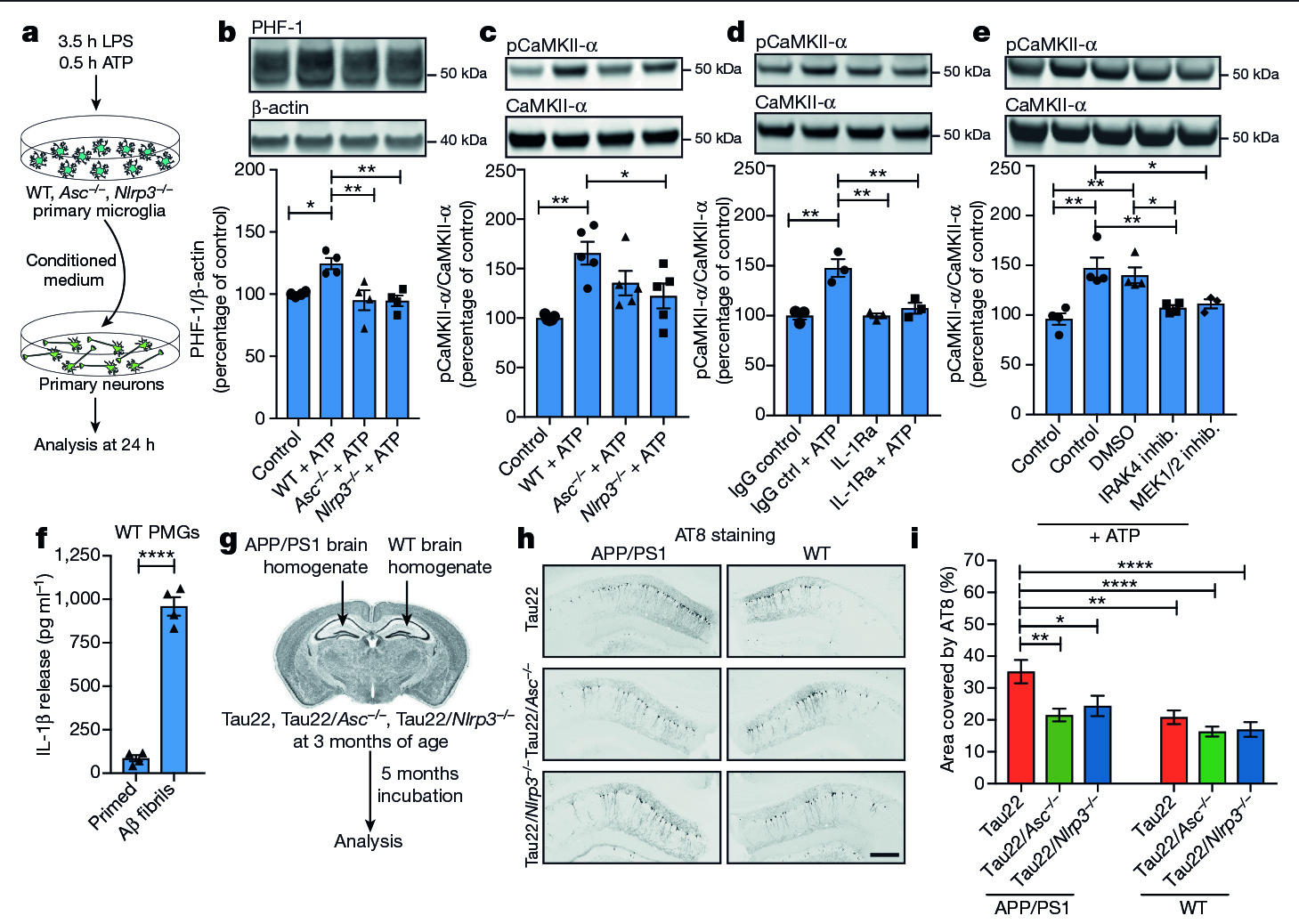
进一步的研究结果显示,在Tau22和ASC或Tau22和NLRP3双缺小鼠中,炎症反应显著降低,病变特征也显著减低,说明tau蛋白突变诱导的神经炎症依赖于NLRP3炎症小体。在ASC或NLRP3缺乏时,诱导tau磷酸化的激酶CaMKII-α和GSK-3β下调,抑制tau磷酸化的PP2A上调,表明NLRP3炎症小体通过调控tau蛋白相关激酶和磷酸酶来调控其活性和病变发生。
总之,本次研究证实了NLRP3炎症小体在tau病变及阿尔茨海默病发生和发展过程中的作用,为抗体药物研发提供了新的思路。抗体药物因其靶点特异性强、效果好,在多种疾病治疗中具有重要作用,已经成为医药领域增长速度最快的发展方向。
单克隆抗体制备技术,随着基因工程技术的完善,先后出现了杂交瘤技术、噬菌体抗体库技术、单个B细胞技术、天然全人源库技术等。那么这些单克隆抗体筛选技术有哪些不同呢?为此,北京义翘神州将于12月5日14:00,针对单克隆抗体筛选平台做专题讲解,从原理、流程、条件优化和案例分析等角度,着眼于实际生产中遇到的现实问题,与大家分享交流。欢迎大家扫描二维码进行报名。








