本文转载自“药明康德”。
近两年来,基因疗法领域取得了重大突破,2017年底,明星基因疗法公司Spark Therapeutics开发的Luxturna获得FDA批准上市,成为首款在美国获批的“体内给药型”基因疗法。而诺华公司开发的Zolgensma也有望在本月获得FDA批准,成为第二款“体内给药型”基因疗法。根据再生医学联盟(ARM)发布的报告,截至到2019年第一季度末,全球有371项基因疗法处于临床开发阶段,与2018年同期相比,增长了17%。
作为递送基因疗法的有力工具,腺相关病毒(AAV)的开发和制造也成为业界的关注焦点之一。近日多家公司通过合作和并购,扩展AAV的设计和制造能力。日前,Nature Reviews Drug Discovery上发表一篇综述,通讯作者是马萨诸塞大学医学院(University of Massachusetts)的基因疗法专家高光坪教授。这篇综述对这一基因疗法递送平台进行了详细介绍,今天药明康德的微信团队将与读者分享这篇文章的精彩内容。

腺相关病毒基本构造和作为基因疗法载体的运作机理
腺相关病毒是一种单链DNA病毒,目前的科学界共识是它不会导致任何人类疾病。它由蛋白衣壳(capside)和长度为4.7kb的单链DNA基因组构成。蛋白衣壳由三个亚基组成,分别为VP1,VP2,和VP3。AAV基因组两端为两个“T”型的末端反向重复序列(inverted terminal repeat, ITR)。这两个ITRs是病毒DNA复制的起点和触发病毒包装的信号。AAV基因组中的rep基因编码4个与病毒复制相关的蛋白,分别为Rep78、Rep68、Rep52、和Rep40。
作为基因疗法载体的重组腺相关病毒(rAAV)携带的蛋白衣壳与野生型AAV几乎完全相同,然而衣壳内的基因组中编码病毒蛋白的部分完全被删除,取而代之的是治疗性转基因(transgene)。AAV基因组中唯一被保留的部分是ITRs,它起到指导基因组的复制和病毒载体组装的作用。将编码病毒蛋白的部分完全删除的优点是:一方面可以最大化重组AAV携带转基因的容量,另一方面减小体内递送转基因时产生的免疫原性和细胞毒性。
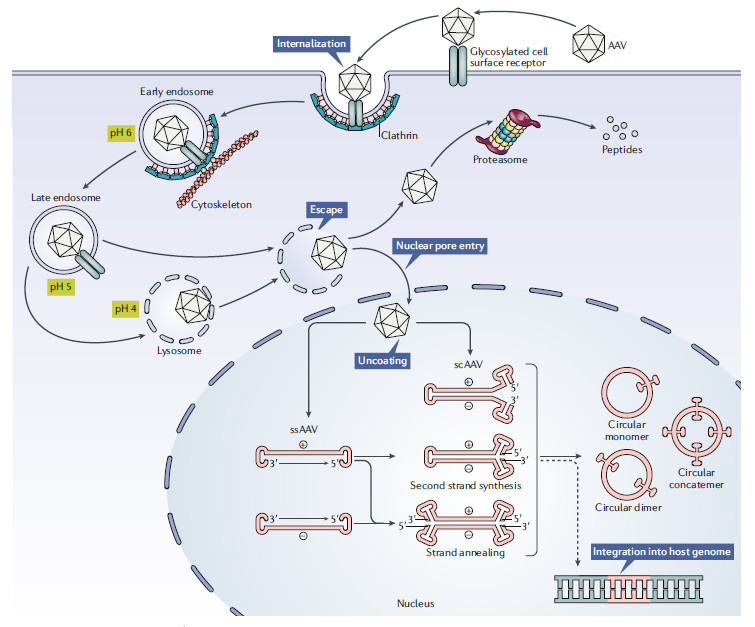
▲重组AAV载体介导转基因表达的过程(图片来源:参考资料[1])
重组AAV颗粒通过与宿主细胞表面表达的糖化受体相结合,通过网格蛋白(clathrin)介导的内吞作用进入细胞。在内吞形成的内体(endosome)酸化之后,病毒衣壳的VP1/VP2部分构象发生变化,导致病毒从内体中脱离,并且通过核孔进入细胞核。进入细胞核后,单链DNA从衣壳中释放出来。这时单链DNA还不能进行转录,它们需要变成双链DNA。单链DNA可以利用宿主细胞的DNA聚合酶来合成互补链,或者两条从不同AAV颗粒中释放的互补链退火(annealing)形成双链DNA。
最新的AAV基因组设计能够将衣壳中携带的单链DNA设计成自我互补(self-complementary)的序列。这种序列的优点在于它不需要单链DNA复制成为双链DNA的步骤就可以进行转录,与传统的单链AAV基因组相比,它的基因表达更为迅速,而且表达量更高。诺华公司开发的治疗脊髓性肌肉萎缩症(SMA)的Zolgensma就使用了这种基因组设计。然而这种设计的一个缺点是AAV携带的转基因容量减半。
双链形式的AAV基因组然后利用ITRs进行分子内或分子间基因组重组,这一过程让AAV基因组成为稳定的游离DNA(episomal DNA),导致基因组能够在不再进行有丝分裂的细胞中持续进行基因表达。
AAV载体的转化应用
截至2018年11月13日,在ClinicalTrials.gov上有145项干预性临床试验中使用重组AAV载体。目前,两款重组AAV载体已经获得批准在患者身上使用,它们是uniQure公司开发的Glybera(AAV1)和Spark Therapeutics公司开发的Luxturna(AAV2)。而诺华公司开发的Zolgensma(AAV9)可能在本月加入获批疗法的行列。
目前,大约有10来种不同血清型的AAV在临床试验中作为基因疗法的载体,基于AAV2的基因递送平台虽然仍然是最多的,但是诸如AAV8,AAV9和AAVrh.10等新一代衣壳正在临床试验中得到更多应用。下面我们来看一看这些临床试验的特征。
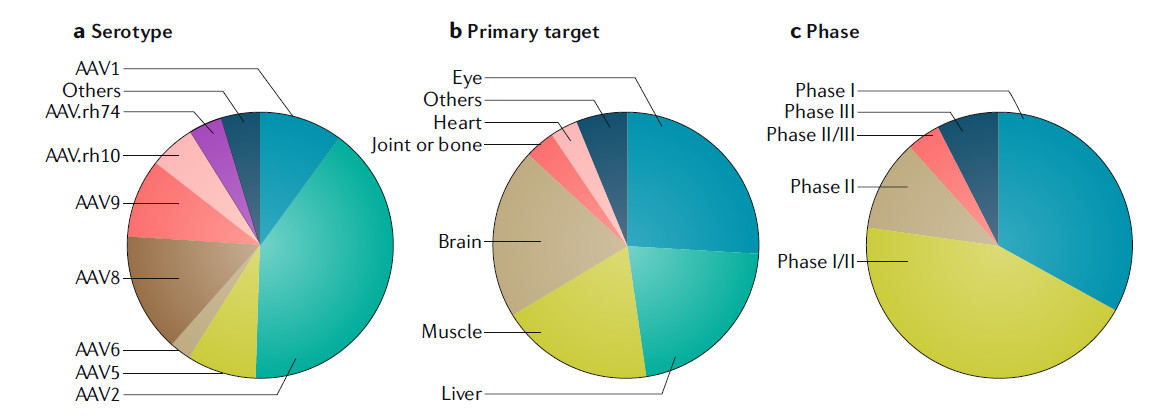
▲干预性AAV基因疗法临床试验简介(图片来源:参考资料[1])
重组AAV载体递送基因的靶向组织
大部分基因疗法研发项目的靶向组织是肝脏、横纹肌和中枢神经系统。几乎所有天然AAV衣壳蛋白能够在肝脏中引发有效的转基因表达,因此靶向肝脏的重组AAV为治疗一系列疾病提供了优良的基因递送平台。它们包括A型和B型血友病、家族性高胆固醇血症等疾病。
AAV8和AAV9衣壳蛋白能够靶向身体中的多种肌肉类型,这让AAV介导的基因疗法能够用于治疗多种肌肉疾病,其中包括杜兴氏肌营养不良症(DMD)。值得一提的是,肌肉可以作为生成治疗性分子的“体内工厂”,因此靶向肌肉组织的基因疗法可以用于治疗非肌肉疾病。
重组AAV递送的基因疗法的另一个重要方向是CNS,包括眼睛和大脑。眼睛是一个相对隔离的环境,直接进行眼内注射递送AAV基因疗法能够达到治疗多种遗传性眼病的效果。Spark Therapeutics公司开发的获批疗法Luxturna就是治疗由于RPE65基因突变而导致失明的患者。
而静脉输入的AAV9和AAVrh.10能够穿越血脑屏障,在神经元和胶质细胞中引发转基因表达。这项重大发现带来多项针对CNS疾病的研究,其中包括SMA,肌萎缩侧索硬化症(ALS),GM1神经节苷脂病,和粘多糖贮积症III型等等。
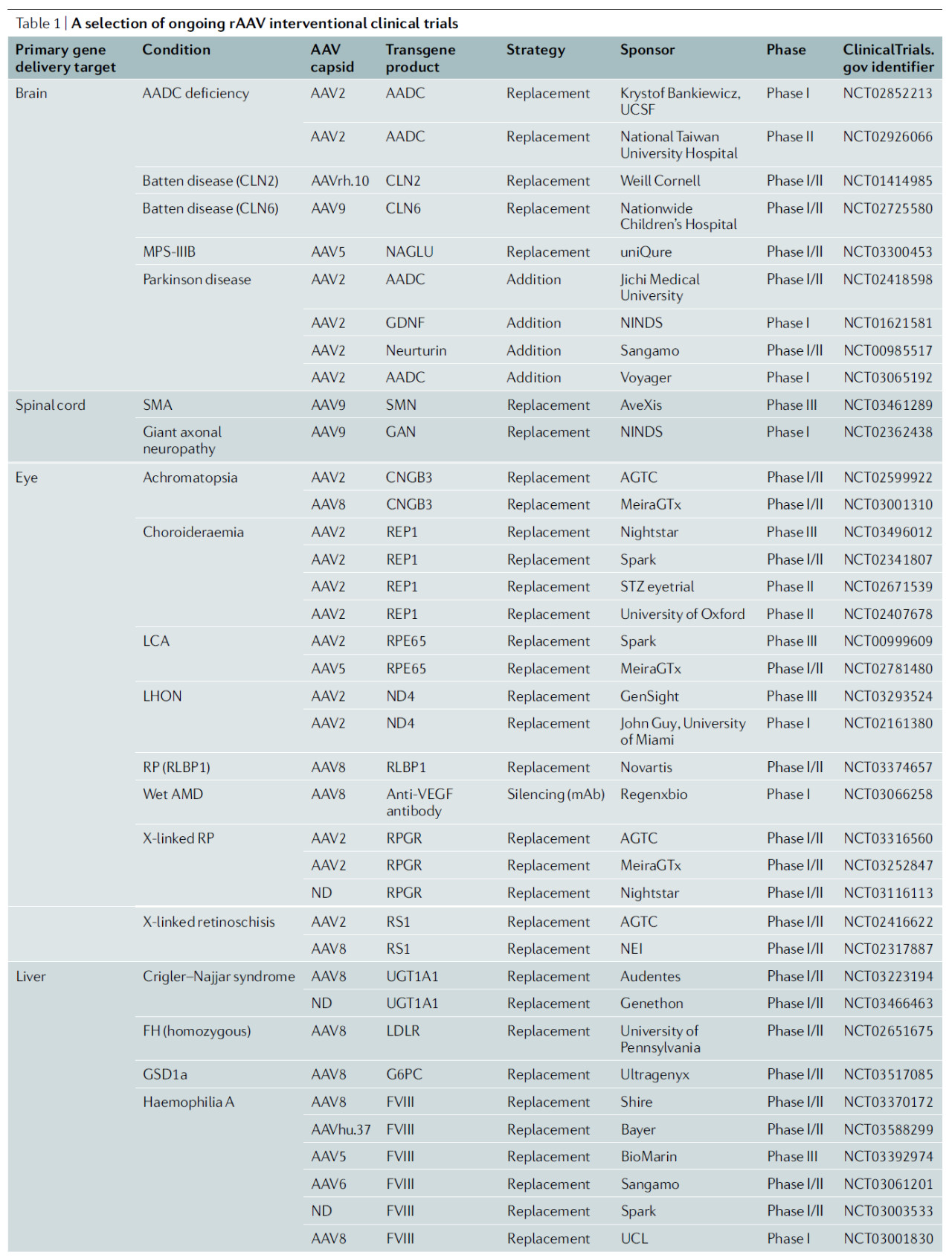

▲部分干预性AAV基因疗法信息(图片来源:参考资料[1])
AAV基因疗法策略
基因替代:这一策略的目标是递送表达正常蛋白的基因来弥补功能丧失性突变的影响。它适用于治疗隐性单基因疾病,已经临床试验中获得极大成功。Glybera和Luxturna就是很好的例子。Glybera基于重组AAV1平台递送表达编码脂蛋白脂肪酶(LPL)的转基因,它用于治疗LPL缺失患者。而Luxturna则使用AAV2平台来递送正常RPE65基因。这两款疗法都使用局部注射的施药方法,分别注射到患者的肌肉和眼睛中。
新一代AAV血清型的发现让研究人员可以通过静脉注射AAV载体将转基因递送到全身。这些新的AAV载体为治疗A型和B型血友病(靶向肝脏),DMD(靶向全身肌肉)和SMA(广发靶向CNS,包括脊髓)带来了有效疗法。本月有望获批的Zolgensma就是一个范例,这是一款利用AAV9载体递送编码运动神经元生存蛋白(SMN)的SMA转基因的基因疗法。在很多疾病中,只需在部分细胞中表达正常基因就足以缓解疾病的症状。
基因沉默:与基因替代相反,基因沉默的目标是治疗由于功能获得性基因突变导致的单基因疾病,例如亨廷顿病(Huntington disease)。RNAi疗法目前是AAV基因沉默平台的首选策略。然而,与合成RNAi疗法的飞速进展相比,基于AAV递送平台的RNAi疗法目前仍处于临床前开发阶段。基因沉默需要在大部分组织中发生才能够起到有意义的治疗效果,在某些器官中(例如大脑),这对于AAV载体来说还是一个挑战。
在RNAi策略以外,使用CRISPR-Cas系统来靶向RNA也是一种基因静默的策略。不过这一策略需要克服的障碍是重组AAV容纳的转基因大小有限,而且从细菌中发现的Cas蛋白可能引发免疫反应,从而降低疗效。
递送新基因:除了治疗单基因疾病以外,AAV介导的基因疗法具有通过递送新基因来治疗复杂遗传病或者传染病的潜力。例如,心力衰竭和传染病代表着具有高度未经需求的疾病领域,通过引入新基因,基因疗法可以提供生长因子,调节与心力衰竭相关的信号通路,以及表达中和致命病毒感染的抗体。目前的临床试验正在检验,使用肌肉作为生成治疗性抗体的“生物工厂”,治疗HIV感染的治疗方法。
改进AAV载体的手段
当重组AAV在20多年前第一次表现出作为基因疗法载体的临床活性之后,研究人员就在不断对衣壳蛋白进行改造,试图赋予它新的功能和特征。随着科技的进步,开发新衣壳蛋白的策略也不断演变。
目前,衣壳蛋白开发的策略可以分为3大类:天然发现,理性设计,和定向进化。随着近年来计算能力和生物信息学预测模型的进展,一个新的衣壳蛋白设计分支出现了。这就是计算机发现(in silico discovery)策略。下面我们来看一看这些不同策略的优缺点。
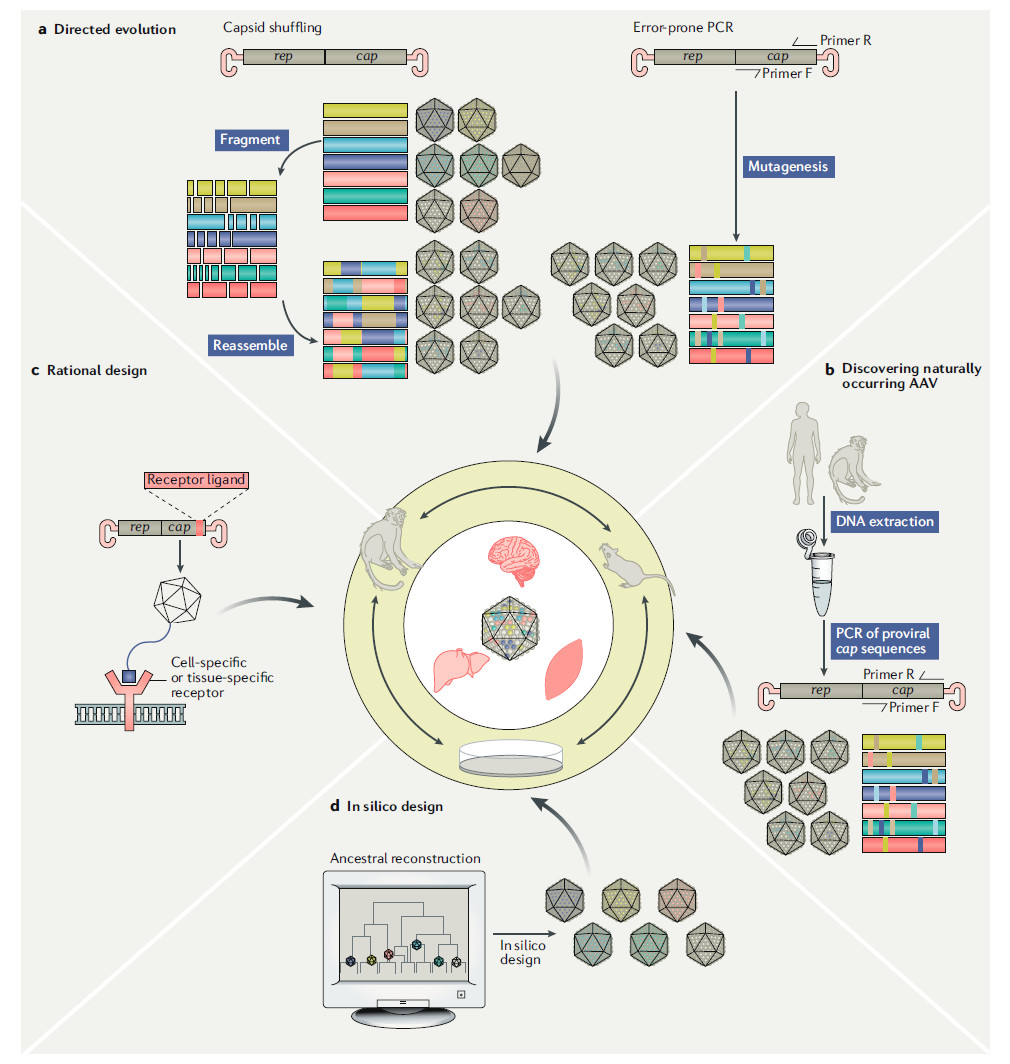
▲改进AAV载体衣壳蛋白的四种策略(图片来源:参考资料[1])
天然发现
目前最具有临床应用潜力的AAV血清型都是从天然来源中分离出来的。其中的范例就是AAV9,它是从人类肝组织中分离出来的。AAV9具有穿越血脑屏障的能力,这让它成为在中枢神经系统(CNS)中递送基因疗法的首选衣壳。除了能够感染CNS的AAV血清型以外,天然人类和非人灵长类(NHP)AAV感染的主要器官为肝脏和脾脏。
然而,使用人类AAV衣壳的一个缺陷是大部分人由于在一生中受到过AAV的感染,导致他们体内携带针对AAV衣壳的抗体。据传染病学统计,40-80%的人体内携带针对AAV的抗体。这可能导致AAV作为基因疗法载体在未递送转基因时就被免疫系统摧毁,降低转基因的表达水平。
解决这一难题的策略包括使用从非人灵长类中分离的AAV衣壳,以及其它脊椎动物中分离的AAV衣壳蛋白。目前,从非人灵长类动物和猪身上获取的AAV衣壳种类在实验中表现出良好的转基因递送能力。
理性设计
理性设计是改良病毒载体衣壳的首选策略之一。最初的改良策略包括将特定多肽序列嫁接在衣壳表面,让它们可以与特定细胞表面的受体相结合。这可以让病毒载体感染原先无法被感染的细胞。
另一个改良病毒载体衣壳的方向是扰乱细胞对衣壳蛋白的降解过程。已有研究表明,通过点突变改变衣壳表面酪氨酸可以在小鼠模型中将转基因在肝细胞中的表达水平提高30倍。这一改变不但抑制了蛋白酶体对AAV衣壳的降解,而且改善了病毒载体在细胞内的运输。
定向进化
由于我们对AAV与细胞表面受体结合,内化,在细胞内运输,以及进行基因表达的生理过程还不够了解,这方面知识的缺陷限制了理性设计的应用。因此,定向进化手段在很多情况下成为优化病毒载体更有效的策略。
定向进化的原则是模拟自然进化的机制,在衣壳蛋白中引入大量随机突变,然后在选择压力下筛选出具有特定生物性质和特征的衣壳。例如,它们可能可以靶向特定组织,或者逃避免疫监控,或者提高转基因的表达。这一策略的优点在于我们不需要对相应的分子机制有深入的了解。
目前,通过容易出错的PCR可以在编码衣壳蛋白的基因中引入大量随机突变,从而建立一个具有丰富多样性的衣壳蛋白库。另一种建立多样性衣壳蛋白库的方法是将不同种类的天然衣壳蛋白中的不同部分随机组合起来构成嵌合衣壳蛋白。
随着下一代测序技术(NGS)的进步,定向进化手段成为更为强大的发现创新病毒载体衣壳的方法。基于NGS开发的筛选技术如今可以每次对上千种携带不同衣壳的病毒载体进行筛选,从而迅速迭代,发现能够在特定细胞或组织中导致基因表达的衣壳蛋白。
In silico生物信息学发现策略
生物信息学和计算机工具可以通过比较不同AAV的衣壳蛋白序列,推断出衣壳蛋白的进化过程,并且发现衣壳蛋白上具备高度多样性的区域。这可以帮助在这些区域引入变异,与定向进化手段相结合,更有效地筛选出新型病毒衣壳蛋白。
结语
基因疗法是获得业界关注的创新治疗平台。而作为递送转基因的有力手段,AAV载体平台的研发也在出现指数型增长。虽然对AAV的研究属于病毒学领域,但是将AAV转化为基因疗法载体的过程需要多学科的联合研究。分子生物学、生物信息学、传染病学、结构生物学、免疫学、和基因组学等方面的突破对AAV载体平台的成功开发都起到不可或缺的作用。
AAV载体平台的发展仍然需要克服多项挑战,其中包括如何经济有效地生成足够数量的治疗性AAV载体,以及克服人体免疫系统对AAV载体和转基因产物的免疫排斥作用。克服这些挑战对推广AAV介导的基因疗法具有关键性的意义。
我们期待随着AAV研发领域的不断扩展和多学科手段的应用,我们能够克服目前遇到的挑战,实现AAV基因疗法的全部潜力。
参考资料:
[1] Wang et al, (2019). Adeno-associated virus vector as a platform for gene therapy delivery. Nature Reviews Drug Discovery. https://doi.org/10.1038/s41573-019-0012-9
[2] AveXis. Retrieved May 20, 2019,
[3] 372项基因治疗临床试验正在进行中,25个基因治疗药物即将到来. Retrieved May 21, 2019,
[4] 25 Up-and-Coming Gene Therapies of 2019. Retrieved May 21, 2019,