本文转载自“澎湃新闻”。
骨关节炎(Osteoarthritis,简称OA),又称退化性关节炎,是与机体衰老密切相关的退行性骨关节病,严重影响老年群体的生活质量。中国40岁以上群体骨关节炎患病率近50%。对于骨关节炎患者,目前尚无安全有效的治疗方法。
有研究表明,间充质干细胞的衰老和耗竭是骨关节炎的诱因之一。然而,如何能使这些干细胞保持“年轻态”?是否能找到缓解或治疗骨关节炎的有效新途径?中国科学院生物物理研究所刘光慧研究组、北京大学汤富酬研究组和中国科学院动物研究所曲静研究组合作4年,最终找到间充质干细胞的“年轻化”因子。

3月26日晚间,上述研究成果以“Maintenance of nucleolar homeostasis by CBX4 alleviates senescence and osteoarthritis”为题发表在国际学术期刊《细胞报告》(Cell Reports)。该研究首次揭示,表观遗传调节蛋白CBX4具有稳定人间充质干细胞核仁异染色质结构、维持细胞年轻化的作用。更为重要的是,基于该蛋白过表达的基因治疗可在小鼠中缓解骨关节炎的病理表型。
刘光慧对澎湃新闻(www.thepaper.cn)记者表示,“细胞衰老不仅同骨关节炎(一种衰老相关疾病)密切相关,还与其他衰老相关疾病(如动脉粥样硬化,肺纤维化,肝纤维化,骨质疏松,神经退行性疾病)有关联,干细胞年轻化因子的发现可能为衰老相关疾病的防治提供崭新的思路。”
维持干细胞年轻态的“开关”
年轻、年老的间充质干细胞究竟有何不同?研究团队对两者的基因表达水平进行检测和对比。刘光慧提到,“实验室经过系统的筛选,目前鉴定出至少5个可维持人间充质干细胞年轻态的单蛋白因子,CBX4是其中之一。”
CBX4是PRC1(Polycomb repressive complex 1)蛋白复合物的组分之一,作为转录抑制因子,其在机体发育和细胞分化过程中发挥表观调控作用。在该研究中,研究团队称,CBX4是维持人间充质干细胞年轻态的重要分子“开关”。
研究团队发现,在衰老的人间充质干细胞中,CBX4表达量显著下调。
为了揭示CBX4随衰老而下调的生物学意义,研究团队利用CRISPR/Cas9基因编辑技术靶向敲除CBX4。和预期相符的是,CBX4缺失可导致人间充质干细胞加速衰老。
研究团队同时证实,将CBX4的基因编码序列克隆到慢病毒载体(lentivirus vector)中,随后导入到衰老的人类间充质干细胞中,过表达CBX4可延缓人间充质干细胞的衰老,使得细胞恢复具有快速生长活力的“年轻态”。
源自人类免疫缺陷病毒(HIV-1)的慢病毒载体可以在体内和体外介导分裂和非分裂细胞的有效转导和稳定表达,目前已成为哺乳动物细胞中基因传递的主要工具。慢病毒载体也已被应用于人类疾病的基因治疗实践中。
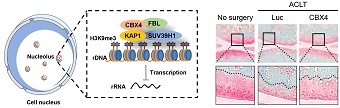
CBX4维持核仁异染色质稳态,抵御细胞衰老及骨关节炎。
研究团队提出,在机制方面,CBX4通过与核仁及异染色质蛋白的相互作用,维持核仁rDNA异染色质稳态,确保rRNA适度转录,防止蛋白质过度翻译,从而维持细胞的年轻状态。
刘光慧表示,“在基础理论方面,(我们的)研究支持了细胞的衰老进程可以被延缓,甚至逆转,这为衰老相关疾病的预防和治疗提供了理论依据。”
小鼠关节炎模型疗效明显
研究团队还进行了初步的动物实验。
据刘光慧介绍,研究团队利用前交叉韧带切断的手术诱导小鼠发生骨关节炎,建立小鼠模型,手术后一周注射编码CBX4的慢病毒载体。
病毒载体的注射部位为骨关节腔,手术后8周,检测关节损伤和恢复情况。研究团队发现,编码CBX4慢病毒载体处理组可以显著增加关节局部的骨密度,抑制韧带切断造成的关节软骨的损伤。此外,治疗组关节软骨的衰老标记物显著降低。
论文第一作者任晓庆博士表示,研究团队还做了骨关节基因表达的分析,揭示关节炎模型组的炎症和细胞死亡相关基因上调表达,细胞增殖和骨分化相关基因下调表达,这与关节炎的病理表型相一致。但这些骨关节炎伴随的异常的基因表达改变可被CBX4基因治疗所抑制。
任晓庆认为,上述结果提示CBX4基因治疗对骨关节炎的干预效果明显。
值得一提的是,关节是相对密闭的腔体结构,针对关节局部基因治疗可以在确保疗效的同时减少副作用。
这些研究或将开辟骨关节炎基因治疗的一个新的方向,为患者带来福音。“之前尚没有通过基因导入细胞‘年轻因子’来治疗骨关节炎的报道。我们的研究表明,衰老的干细胞可以被用作治疗衰老相关疾病的有效靶标。”刘光慧表示。
论文提到,该研究从概念上证明了通过基因导入干细胞‘年轻因子’治疗骨关节炎的可行性,为衰老相关疾病的干预提供了全新的解决方案,在老年医学和再生医学中具有广阔的应用前景。






