近年来PD1的崛起开启了肿瘤的免疫治疗崭新时代,造福众多癌症患者。人体免疫调节机制复杂,其实免疫靶点不只PD1一种,近期研究还发现了LAG-3这一通路。该靶点与T细胞的抑制相关,对此多家公司也成功开发了相应的药物,而且这些药的初步临床数据可观,日后有望成为另一“PD1”。今天小编就给大家分享LAG-3的作用机制及目前的研究数据。
LAG-3介绍,肿瘤的另一个“免疫刹车”
LAG3(lymphocyte activation gene 3,LAG3,CD223)是一种免疫检查点受体蛋白,主要表达在活化的T细胞、NK细胞、B细胞和浆细胞树突细胞。LAG3主要通过与配体MHC II分子的结合,下调T细胞的活性。同时,LAG3也可增强调节性T细胞(Treg)的抑制活性。利用治疗性抗体抑制LAG3,可解除对T细胞的抑制,增强机体免疫应答。
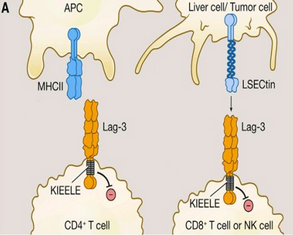
LAG-3对T细胞的负调节机作用
1、LAG-3负向调节CD4+T细胞的增殖和功能:LAG-3与MHC-Ⅱ 类分子结合后, 通过胞内信号转导, 抑制Th1细胞的增殖和相关因子(IL-2、IFN-γ 和肿瘤坏死因子(tumor necrosis factor, TNF)等)的分泌。加入抗LAG-3抗体或敲除LAG-3基因后, CD4+T细胞的数量和功能得以恢复, 促进T细胞的增殖和其细胞因子的分泌。
2、LAG-3负向调节CD8+T细胞的增殖和功能:体内阻断LAG-3或敲除LAG-3基因的小鼠中, 抗原特异性的CD8+T细胞不仅数量上升, 而且其细胞毒活性也增强, IFN-γ 分泌也明显增加, 且作用过程并不依赖CD4+T细胞的参与,还可以防止CD8+T细胞形成长期的免疫耐受。
3、LAG-3对Treg细胞功能的调节:集中于肿瘤病灶的Treg细胞高表达LAG-3,LAG-3+/+Treg细胞可明显抑制效应T细胞的功能, 但LAG-3-/-Treg细胞的抑制功能显著减弱。Treg细胞上表达的LAG-3可与DC细胞膜上的MHC Ⅱ类分子结合, 通过胞质信号传导, 抑制DC的成熟, 并能诱导耐受的DC形成, 从而抑制T细胞的活化与增殖。
LAG-3对T细胞的负调节机作用
1、LAG-3负向调节CD4+T细胞的增殖和功能:LAG-3与MHC-Ⅱ 类分子结合后, 通过胞内信号转导, 抑制Th1细胞的增殖和相关因子(IL-2、IFN-γ 和肿瘤坏死因子(tumor necrosis factor, TNF)等)的分泌。加入抗LAG-3抗体或敲除LAG-3基因后, CD4+T细胞的数量和功能得以恢复, 促进T细胞的增殖和其细胞因子的分泌。
2、LAG-3负向调节CD8+T细胞的增殖和功能:体内阻断LAG-3或敲除LAG-3基因的小鼠中, 抗原特异性的CD8+T细胞不仅数量上升, 而且其细胞毒活性也增强, IFN-γ 分泌也明显增加, 且作用过程并不依赖CD4+T细胞的参与,还可以防止CD8+T细胞形成长期的免疫耐受。
3、LAG-3对Treg细胞功能的调节:集中于肿瘤病灶的Treg细胞高表达LAG-3,LAG-3+/+Treg细胞可明显抑制效应T细胞的功能, 但LAG-3-/-Treg细胞的抑制功能显著减弱。Treg细胞上表达的LAG-3可与DC细胞膜上的MHC Ⅱ类分子结合, 通过胞质信号传导, 抑制DC的成熟, 并能诱导耐受的DC形成, 从而抑制T细胞的活化与增殖。
与PD1相辅相成,联合用药或可倍增疗效
其实,LAG-3的免疫抑制功能恰巧与PD-1的耐受机制相符,LAG-3不但抑制具有抗肿瘤活性的CD8+ T细胞的增殖,而且直接影响其免疫功能,与此同时,LAG-3还能增强调节性T细胞的抑制活性,进一步抑制免疫应答。同时低表达LAG-3正是记忆T细胞的特征之一。
临床数据还显示,在多种癌症类型中,如黑色素瘤、结肠癌、乳腺癌等,肿瘤浸润淋巴细胞(TILs)表达LAG-3,这与癌细胞侵略性的临床特征相关联。而阻断LAG-3则可以逆转以上的抑制作用,恢复CD8+T细胞增殖和活性,并减少调节性T细胞数量;而且还提高了T细胞免疫应答的敏感度。同时再阻断PD-1,免疫反应会协同性增强,抑制肿瘤。
初步临床疗效可观,上市在望
目前主要有两类LAG-3调节剂用于治疗癌症,分别是可溶性LAG-3重组蛋白(Prima Biomed开发的IMP321/eftilagimod alpha)及LAG-3抗体(已有多加公司研发了LAG-3单抗)。下面小编讲讲已报道的LAG-3调节剂临床数据。
1. 百时美施贵宝的Relatlimab独领先锋,黑色素瘤后线疗效出炉
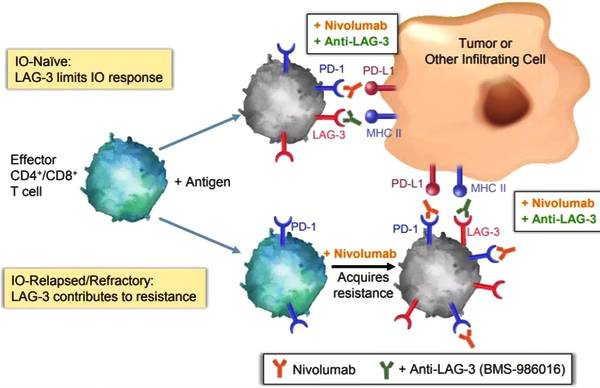
上图为Relatlimab联合nivolumab的双靶点作用机理
BMS作为老牌药物研发公司,早已研发了Relatlimab (BMS-986016),作为LAG-3单抗。在一项I/IIa期临床试验中,共纳入了经PD1/PDL1单抗治疗后进展的68例黑色素瘤患者,使用Relatlimab 80mg+nivolumab(纳武单抗,PD1单抗)240mg,q2w。其中46%患者的既往治疗线数≥3。61例可评估患者中,客观有效率(ORR)是11.5%,包括1例完全缓解(CR)及6例部分缓解(PR)。分层分析,LAG3表达≥1%患者的ORR是LAG3<1%的3.5倍,差距显著。说明LAG3表达是该联合治疗的预测治疗。

Relatlimab和Opdivo耐受性良好,安全性与Opdivo单药治疗相似,并且改善了对抗PD-1 / PD-L1产生耐药性的黑素瘤群体的治疗效果。研究初步展现了LAG3单抗联合PD1后线治疗黑色素瘤的疗效,为经多线治疗失败后的患者提供新的可行方案,更是可以作为PD1/PDL1耐药后的保底治疗手段。基于以上数据,这项临床试验要扩增招募人数至1000例。
2. Prima Biomed研发的Eftilagimod alpha,联合紫杉醇在转移性乳腺癌一线治疗中初见成效。
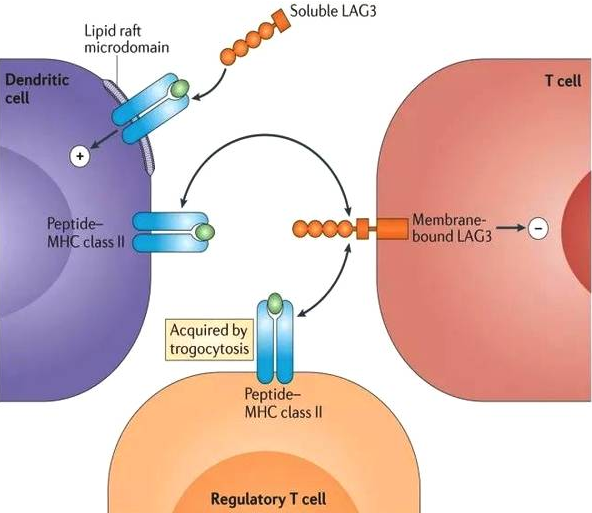
上图为Eftilagimod alpha作用机理
该I期试验共纳入15例激素受体阳性的转移性乳腺癌患者(67%接受过激素治疗),分别在第1、8、15天接受紫杉醇,第2、16天联合Eftilagimod alpha皮下注射6 mg(6例患者)和30 mg(9例患者),持续6周期;无疾病进展的患者将每一个月接受一次 Eftilagimod alpha单药,最多12次。
结果显示,联合用药不仅增加了体循环的单核细胞、树突状细胞和CD8 T细胞数量,还提高其免疫活性和时间。ORR为47%(7例部分缓解),DCR为87%。试验安全性可耐受。试验表明,Eftilagimod alpha能稳定持续地激活抗原递呈细胞和T细胞,疗效可观。
3. Eftilagimod alpha联合Pembrolizumab治疗黑色素瘤,疗效可观
该I期试验纳入了经三个周期Pembrolizumab治疗后未完全缓解或病情发展的患者,用2 mg/kg Pembrolizumab 联合1 mg、6 mg或30 mg Eftilagimod alpha每两个星期一次,持续6个月。
结果显示,入组的18例患者中,没有因为副反应退出治疗的患者。ORR为50%,包括1例既往Pembrolizumab治疗后进展的患者达到完全缓解。结果说明联合用药可以增加治疗疗效,即使PD1治疗失败后仍然有效。
4. Prima BioMed另一LAG-3单抗——LAG525,联合PD1(Spartalizumab)治疗恶性肿瘤亦显疗效
该I/II期试验纳入121例患者采用联合用药的方案治疗,患者中有 11例部分缓解、1位完全缓解,其中包括2/8例间皮瘤和2/5例三阴性乳腺癌患者。结果证明患者对联合用药基本耐受并且其免疫系统得以调控。该试验数据对晚期实体瘤和血液恶性肿瘤的后期试验奠定很好的基础。
多个LAG-3调节剂已在研究阶段,和PD1联合使用成为发展趋势
医药魔方全球新药数据库显示,全球共有24款涉及LAG3靶点的在研项目,其中7款为国产在研品种。除eftilagimod alpha和AVA-017(LAG3拮抗剂)外,均为治疗性抗体。从研发进展来看,5款产品处于临床2期,7款处于临床1期,其余12款均为临床前研究阶段。全球进展最快的是BMS的relatlimab,正在进行黑素瘤II/III期和胃癌II期临床试验研究。
24款在研产品中,详情如下表。
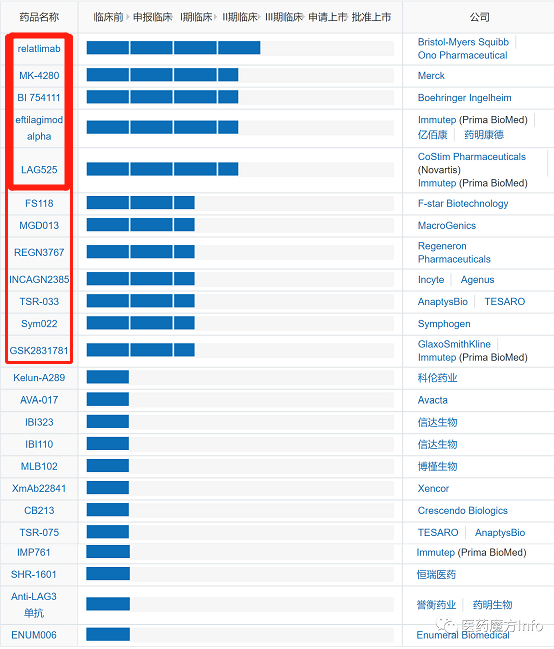
上表中红框为进入临床研究的LAG-3调节剂,粗框为步入临床II期的LAG-3调节剂。
(表格源于医药魔方Info)
结论
①作为免疫治疗另一靶点,LAG-3在初步的临床数据中展现客观的疗效。
②LAG-3调节剂+PD1单抗可同时作用于免疫双靶点,各大企业满腔期待疗效能1+1>2,联合治疗是目前临床试验用药的发展趋势。
③联合治疗对PD1治疗失败后仍然有效,可以作为耐药/治疗失败的保底方案。
④初步结果说明LAG-3表达水平可影响疗效,其或将成为有效的预测标志物。
⑤目前为止安全性都可耐受。
综上,小编同大家一起期待新药的到来。







