本文转载于“bioart”。
在受精卵的分裂和发育过程中,第一次细胞命运的选择发生在什么时期?这一选择是如何发生的?这是生殖与发育生物学研究的一个重要基础问题。过去的研究表明,第一次细胞命运的启始发生在4-细胞期,那么在更早的2-细胞胚胎时期,细胞命运的选择是否有可能已经启动了呢?2018年12月13日,同时在线的两篇文论首次将小鼠第一次细胞命运决定的选择“推到”了2-细胞胚胎时期,为探索早期胚胎的全能性调控以及第一次细胞命运分化机理奠定了重要基础。此外,文章还明确了长链非编码RNA在早期胚胎发育与细胞命运决定中的重要作用。这两项“背靠背”成果相互印证,互为补充,初步解决了发育生物学上的重大基础科学问题。有鉴于此,BioArt特别邀请到了长期从事非编码RNA相关研究的北京大学汪阳明研究员和中科院生化细胞所陈玲玲研究员对该工作进行点评,以飨读者!
点评 | 汪阳明(北京大学分子医学所)
陈玲玲、王洋(中科院生化与细胞所)
解读 | 程然然
责编 | 迦溆
一个哺乳动物个体有超过200种不同类型的细胞,而所有的细胞类型都起始于具有全能性的受精卵(即合子, zygote),受精卵经过卵裂形成不同卵裂期胚胎,然后发育形成具有不同命运、分子特性和位置的两种细胞组成的囊胚 (blastocyst)【1】。着床前胚胎发育主要是指受精卵到囊胚的发育,传统观点认为,这个过程经历了两次主要的不对称细胞分裂 (8-16细胞和16-32细胞两个阶段)和第一次细胞命运的决定【2】。囊胚是由内细胞团 (inner cell mass, ICM) 和滋养外胚层 (trophectoderm, TE) 组成:内细胞团经过细胞增殖和第二次细胞命运的决定形成原始内胚层 (primitive endoderm) 和上胚层 (epiblast, EPI),它们为三胚层形成、器官发生和形态的建立打下基础;而滋养外胚层继续发育成为胚外外胚层 (extraembryonic ectoderm, ExE) 和外胎盘锥 (ectoplacental cone)【2】。
图片引自:https://leftcoastvoices.wordpress.com/tag/zygote/
在受精卵的分裂和发育过程中,第一次细胞命运的选择发生在什么时期?这一选择是如何发生的?这是生殖与发育生物学研究的一个重要的基础问题。随着单细胞转录组、单细胞基因组以及单细胞表观遗传组等相关技术的快速发展,越来越多的证据表明,早期胚胎在出现形态上的不对称分布之前,早在4-8细胞期就已经出现了分子水平的不对称,并认为不同卵裂球之间分子水平的不对称分布是决定卵裂球向ICM或TE分化的关键【3】。研究发现,4-细胞期卵裂球之间H3R26me (组蛋白H3精氨酸26位点的一甲基化)的表达差异决定了细胞命运。高表达H3R26me的卵裂球偏向于ICM命运,而表达量低的则优先形成TE【4】。H3R26me的产生与CARM1 (Coactivator-associated arginine methyltransferase 1, H3特定的精氨酸甲基转移酶)密切相关【4】。4-细胞期高表达的CARM1通过CARM1/PRDM14-OCT4/SOX2-SOX21轴来使细胞优先贡献到ICM,表明第一次细胞命运的启始时间发生在4-细胞期【5】。然而4-细胞期细胞异质性是否起源于2-细胞期?早在2015年,由动物所周琪、段恩奎、陶毅等合作团队通过对早期单卵裂球单细胞测序数据的分析和数学建模已发现第一次卵裂后,发现2-细胞期卵裂球的的表达谱通过随机分布已经出现了微小的异质性,并且随着合子激活,一些分子的卵裂球之间的异质性逐渐放大【6】,其中CARM1就符合这种变化规律,但仍不清楚这种异质性是否与其后期细胞命运的决定有关。换言之,就是说在更早的2-细胞胚胎时期是否有可能已经启动了细胞命运的选择呢?
有趣的科研问题总会引起科学家们的广泛关注。12月13日,Cell同期发表了两篇来自两个独立课题组的相似研究,一篇是来自中国科学院动物研究所周琪课题组与李伟课题组的合作研究论文Asymmetric Expression of LincGET Biases Cell Fate in Two-Cell Mouse Embryos,另一个是来自英国剑桥Magdalena Zernicka-Goetz课题组的论文CARM1 and Paraspeckles Regulate Pre-implantation Mouse Embryo Development。这两个课题组同时发现2-细胞卵裂球的异质性决定了后期细胞命运,把第一次细胞命运的启始时间提前至2-细胞期,进一步打开了早期胚胎发育的黑匣子,这是发育生物学领域重要突破性成果。两个工作结果均表明CARM1在2-细胞期的异质性对细胞命运的决定起着重要作用,但分子机制的侧重点不同。
一、

周琪课题组和李伟课题组的工作着手于LincGET (內源逆转录病毒相关的长非编码RNA),LincGET是周琪课题组与东北农业大学刘忠华课题组合作于2016年发现的,是小鼠胚胎发育超过2-细胞期所必需的,相关工作发表在EMBO Reports上【7】。鉴于LincGET在小鼠发育中具有如此重要的功能,周琪和李伟两课题组合作团队的研究人员对LincGET在早期细胞命运决定中的作用及详细机制进行了进一步深入探索。研究发现,LincGET的表达水平在小鼠2-细胞期和4-细胞期的各个卵裂球之间是不均等的。通过显微注射的方法在2-细胞胚胎的一个卵裂球中过表达LincGET,能使该卵裂球的子细胞选择内细胞团(inner cell mass, ICM)命运。进一步的机制研究显示,LincGET与CARM1形成复合体,偏好性地结合转座序列,建立激活型染色质修饰H3R26me2,增加全基因组染色质的开放程度,提高多能性相关基因的表达水平,从而促使具有更高LincGET表达水平的胚胎细胞倾向于选择ICM命运(下图)。
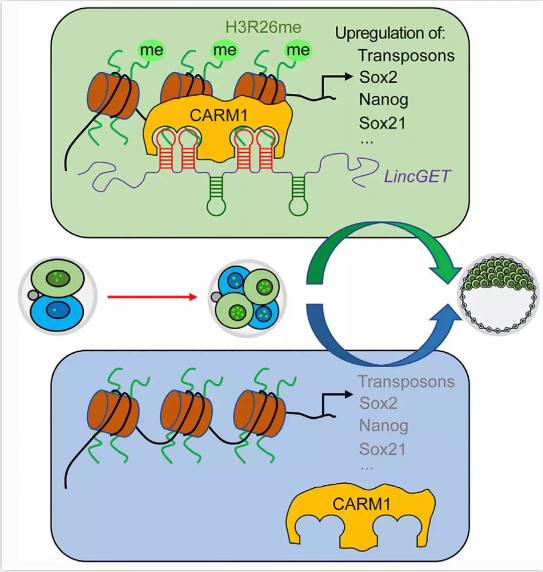
该工作首次将小鼠第一次细胞命运分化的选择提前至2-细胞胚胎时期,并发现其关键分子是一个内源逆转录病毒相关的长非编码RNA。这将为探索早期胚胎的全能性调控以及第一次细胞命运分化机理奠定重要基础,并为建立更高多能性甚至全能性的干细胞提供了新的理论参考。同时,该研究也拓展了长非编码RNA的功能研究,为研究早期胚胎中内源逆转录病毒序列和长非编码RNA的功能提供了新的思路。
据悉,该研究工作由中国科学院动物研究所和中国科学院干细胞与再生医学创新研究院合作完成。博士后王加强、王乐韵、副研究员冯桂海、助理研究员王昱凯为论文共同第一作者,周琪研究员和李伟研究员为论文的共同通讯作者。
二、

Magdalena Zernicka-Goetz课题组的研究则着重于早期细胞核的结构变化对后期细胞命运的决定。高等动物的细胞核含有多个核小体,介导着不同的分子过程,从DNA复制到RNA转录和加工。哺乳动物细胞核结构的动态变化研究主要集中在核仁和Cajal小体,然而对于其他的nuclear domains,如IGCs(interchromatin granule clusters), PGs (perichromatin granules), nuclear speckles和paraspeckles以及它们相关的蛋白在哺乳动物胚胎发育中研究较少。Paraspeckles是存在于IGCs中的一种无膜动态变化结构,富含PSPC1, p54nrb和SFPQ三种蛋白。一种特殊的长非编码RNA, NEAT1 (nuclear paraspeckle assembly transcript 1)和其正在进行的转录状态是 paraspeckles结构的完整性所必需的(陈玲玲课题组2015年发表在Gene & Dev上的工作)【8】。前期研究表明,Paraspeckles可以动态响应不同的生理过程,如细胞分化、病毒感染和代谢改变等,而且CARM1可以通过p54nrb与paraspeckles相互作用。
该研究首先确定了CARM1在2-细胞到4-细胞转变过程中存在异质性,而且这种异质性与H3R26me2的修饰相关,通过对CARM1的定位分析,发现大多数的CARM1与Paraspeckles的两个重要组成部分p54nrb和PSPC1在2-细胞和4-细胞期存在共定位。通过显微注射的方法在合子以及2-细胞胚胎的一个卵裂球中注射p54nrb的siRNA敲低p54nrb,均导致CARM1的表达显著下降,进一步降低了H3R26me2水平。Paraspeckles的完整性与NEAT1密切相关【8】, NEAT1的缺失是否与p54nrb的缺失引起相同的结果呢?
通过显微注射Neat1的ASOs (anti-sense oligonucleotides)对NEAT1进行敲低破坏了Paraspeckles的完整性并降低了CARM1的表达,这表明Paraspeckles的组成部分与CARM1的水平密切相关。随后研究人员通过对CARM1的过表达和敲低研究,发现CARM1与Paraspeckles的组成以及动态变化存在反馈调节。敲除NEAT1或者p54nrb导致胚胎发育停滞在16-到32-细胞期,伴随着Cdx2表达的增加,促进胚胎细胞倾向于选择TE命运。然而,CARM1敲除的胚胎可以形成囊胚,这表明Paraspeckles不仅作为CARM1的上游调控因素,而且在调控CARM1之前还具有其他细胞命运决定的功能。
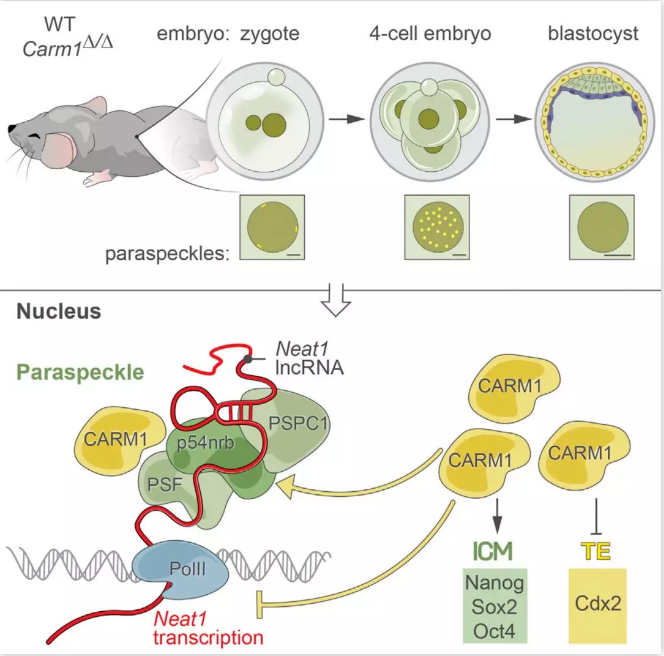
该工作为单细胞核结构在早期胚胎发育以及细胞谱系的建立研究提供了一个新的视角,并且为理解细胞核结构和空间变化如何调控基因表达,进而影响胚胎发育过程铺平了道路。同样涉及长非编码RNA,拓展了其在核结构动态变化过程中的作用。
两项工作相互补充,互为支持,对早期胚胎细胞命运的决定、细胞谱系的建立及其发生与发展的调控机制提供了新的视野。同时对预防和减少早期疾病的发生,指导胚胎干细胞及多潜能干细胞的分化具有重要的生物学意义。
专家点评
01
汪阳明(北京大学分子医学所,研究员)
第一次细胞分化何时发生以及如何调控堪称哺乳动物胚胎发育研究的“The million dollar question"。尽管理论上这一事件最早可以发生在合子细胞第一次分裂时,前人的结果仅在四细胞期时观察到了细胞命运的偏移。周琪和李伟合作团队的这一研究毫无疑问地将这一领域推到了最新的前沿,首次证明了在小鼠二细胞胚胎期后期呈不对称分布的LincGET分子具有促进胚胎细胞向内细胞团细胞分化的能力。
由于LincGET是一个内源逆转录病毒相关的长非编码RNA,而大量内源逆转录病毒在二细胞期短暂活跃表达,该研究也给非编码RNA和内源逆转录病毒的功能研究带来了新的方向。例如,内源逆转录病毒相关的编码基因或者非编码RNA是否也有决定胚胎细胞分化为胚外细胞的能力甚至具有其它功能?这一调控模式是否在其他哺乳动物中也保守?LincGET或其调控分子CARM1是否可以被用来增强早期胚胎细胞或者体外干细胞的全能性,体细胞重编程或者体细胞克隆的效率?
值得一提的是,同期Cell出版的Zernicka-Goetz等人的文章发现CARM1受到另外一个长非编码RNA NEAT1的调控,LincGET与NEAT1之间是否存在相互调控或者独立发挥功能是未来值得探讨的课题。更重要的是,早期胚胎发育中选择非编码RNA的调控是否有其内在的原因或者不可否认的优势?最后,在拓展新的概念和新的方向的同时,文章的主要结论即LincGET不对称分布调控二细胞胚胎期细胞命运偏好将得益于更多的实验证据。例如,细胞谱系追踪或者实时成像实验将可以确认无误地显示高或者低表达LincGET的细胞的最终命运;基于CRE/LOXP或者CRISPR的条件性敲除或敲低LincGET将进一步消除对LNA方法所带来的脱靶效应的担心。
02
胚胎细胞的“第一次”命运选择
王洋(陈玲玲实验室博士生,2018年发表一作NCB)、陈玲玲(中科院上海生化与细胞研究所,研究员)
在哺乳动物早期胚胎发育过程中,由于卵裂期细胞在形态上不可区分,它们的命运是相对灵活的。最近的研究结果表明分子异质性在4-细胞期和8-细胞期胚胎时已经存在,这一异质性预先决定了早期囊胚的命运朝向内细胞团细胞(inner cell mass, ICM)或滋养外胚层细胞(trophectoderm, TE)。蛋白精氨酸甲基转移酶CARM1(coactivator associated arginine methyltransferase 1),也被称为PRDM4(protein arginine N-methyltransferase 4),首次被发现不对称的分布于小鼠4-细胞期的各细胞之间,同时高表达的CARM1会导致H3R26me2,使得囊胚向ICM方向发育(Torres-Padilla et al., 2007)【4】。后续的研究表明高表达的CARM1在4-细胞期增加了OCT4/SOX2-DNA的结合组分及其下游的靶向基因如Sox21的表达(Goolam et al., 2016; Plachta et al., 2011; White et al., 2016)【3,9,10】。此外,PRDM14在4-细胞期也被发现存在异质性分布,它与CARM1相互作用促进H3R26me2 (Burton et al., 2013)【6】。这些结果表明4-细胞期胚胎阶段中高表达的CARM1/PRDM14会促进卵裂球更加倾向于向ICM分化。然而这些结果没有指出在4-细胞期所观察到的这些关键蛋白的异质性是如何发生的,也没有明确受精卵分裂和发育过程中,第一次细胞命运的选择发生在什么时期以及这一选择如何发生。
分子生物学中心法则介绍了遗传信息存储在DNA,经由RNA传递到蛋白质发挥功能。近年来研究发现RNA不仅仅只承担遗传信息中间载体的角色,长非编码RNA(long noncoding RNA, lncRNA)则更多地承担了各种调控功能。目前关于lncRNAs的功能正逐步被揭示,然而lncRNAs是否活跃在早期胚胎发育的细胞命运的决定过程中尚未明确。
近日,《Cell》同期在线发表了来自剑桥大学的Zernicka-Goetz实验室的题为“CARM1 and Paraspeckles Regulate Pre-implantation Mouse Embryo Development”和中国科学院动物研究所周琪实验室与李伟实验室的题为“Asymmetric expression of LincGET biases cell fate in 2-cell mouse embryos”的研究论文。这两项研究将受精卵分裂和发育过程中第一次细胞命运的选择发生时期“提前”到了2-细胞期时期,并首次报导了两条不同的长非编码RNAs, Neat1和LincGET,在2-细胞期和4-细胞期的不同细胞之间的差异表达影响了CARM1的功能及细胞的第一次命运选择。这两篇工作从不同角度分析和诠释了受精卵卵裂期CARM1的异质表达。已知CARM1在细胞内会聚集并被Neat1招募形成核内小体paraspeckle (Hu et al., 2015)【8】。
Hupalowska等人研究发现在2-细胞期和4-细胞期,Neat1转录并招募包括CARM1在内的paraspeckle proteins (PSPs)形成paraspeckles。这一过程与CARM1抑制Neat1的表达形成负反馈调控。在4-细胞期中,Neat1、p54nrb的差异表达会影响paraspeckles的正常组装,进而影响了CARM1的表达、定位和功能。这一差异最终影响了CARM1底物H3R26的甲基化分布,影响了偏向ICE、TE发育的基因Nanog、Sox2、Oct4、Cdx2等的表达而决定细胞分化的命运 (Hupalowska et al., 2018)【11】。
在另一项周琪课题组与李伟课题组合作的工作中,早期卵裂球的单细胞测序发现了内源逆转录病毒相关的长非编码RNA LincGET是小鼠胚胎发育超过2-细胞期所必需的。此外,LincGET的表达在小鼠胚胎卵裂过程中2-细胞期、4-细胞期的各个细胞之间是不均等的。通过显微注射的方法在2-细胞胚胎的一个细胞中过表达LincGET,能使该细胞的子细胞选择发育成内细胞团命运。这一结果明确了LincGET在2-细胞期和4-细胞期中的差异表达会影响卵裂球中细胞的命运选择。结合RNA pulldown、质谱分析、免疫荧光、RNA原位杂交等实验,作者发现LincGET通过与CARM1形成复合体发挥调节促进了内细胞团倾向基因的表达。LincGET-CARM1偏好性地结合转座序列,建立激活型染色质修饰H3R26me2,增加全基因组染色质的开放程度,提高多能性相关基因的表达水平,最终促使具有更高LincGET表达水平的胚胎细胞倾向于选择ICM命运倾向(Wang et al., 2018)【12】。
这两项工作利用小鼠模型诠释了2-细胞期和4-细胞期胚胎中异质性CARM1形成的原因,首次将小鼠第一次细胞命运分化的选择的分子机制“推到”了2-细胞胚胎时期,为探索早期胚胎的全能性调控以及第一次细胞命运分化机理奠定重要基础。此外建立哺乳动物模型明确了LincGET在胚胎发育过程中的功能,为深入研究早期胚胎中内源逆转录病毒序列和长非编码RNAs提供了新思路。
原文链接:
https://www.cell.com/cell/fulltext/S0092-8674(18)31564-2
https://www.cell.com/cell/fulltext/S0092-8674(18)31519-8
参考文献:
1.Johnson, M. H., & Ziomek, C. A. (1981). The foundation of two distinct cell lineages within the mouse morula. Cell, 24(1), 71-80.
2. Morris, S. A., Teo, R. T., Li, H., Robson, P., Glover, D. M., & Zernicka-Goetz, M. (2010). Origin and formation of the first two distinct cell types of the inner cell mass in the mouse embryo. Proceedings of the National Academy of Sciences, 200915063.
3. Goolam, M., Scialdone, A., Graham, S. J., Macaulay, I. C., Jedrusik, A., Hupalowska, A., ... & Zernicka-Goetz, M. (2016). Heterogeneity in Oct4 and Sox2 targets biases cell fate in 4-cell mouse embryos. Cell, 165(1), 61-74.
4. Torres-Padilla, M. E., Parfitt, D. E., Kouzarides, T., & Zernicka-Goetz, M. (2007). Histone arginine methylation regulates pluripotency in the early mouse embryo. Nature, 445(7124), 214.
5. Shi, J., Chen, Q., Li, X., Zheng, X., Zhang, Y., Qiao, J., ... & Duan, E. (2015). Dynamic transcriptional symmetry-breaking in pre-implantation mammalian embryo development revealed by single-cell RNA-seq. Development, dev-123950.
6. Burton, A., Muller, J., Tu, S., Padilla-Longoria, P., Guccione, E., & Torres-Padilla, M. E. (2013). Single-cell profiling of epigenetic modifiers identifies PRDM14 as an inducer of cell fate in the mammalian embryo. Cell reports, 5(3), 687-701.
7. Wang, J. et al. Anovel long intergenic noncoding RNA indispensable for the cleavage of mousetwo-cell embryos. EMBO Rep 17, 1452-1470
8. Hu, S. B., Xiang, J. F., Li, X., Xu, Y., Xue, W., Huang, M., ... & Chen, L. (2015). Protein arginine methyltransferase CARM1 attenuates the paraspeckle-mediated nuclear retention of mRNAs containing IRAlus. Genes & development, 29(6), 630-645.
9. Plachta, N., Bollenbach, T., Pease, S., Fraser, S.E., and Pantazis, P. (2011). Oct4 kinetics predict cell lineage patterning in the early mammalian embryo. Nat Cell Biol 13, 117-123.
10. White, M.D., Angiolini, J.F., Alvarez, Y.D., Kaur, G., Zhao, Z.W., Mocskos, E., Bruno, L., Bissiere, S., Levi, V., and Plachta, N. (2016). Long-Lived Binding of Sox2 to DNA Predicts Cell Fate in the Four-Cell Mouse Embryo. Cell 165, 75-87.
11. Hupalowska, A., Jedrusik, A., Zhu, Meng., Bedford, M.T., Glover, D.M.(2018). CARM1 and Paraspeckles Regulate Pre-implantation Mouse Embryo Development. Cell 175, 1-15.
12. Wang, J.Q., Wang, L.Y, Feng, G.H., Wang, Y.K., Li, Y.F., Li, X., Liu, C., Jiao, G.Y, Huang, C., Shi, J.C., Zhou, T., Chen, Q., Liu, Z.H., Li, W., Zhou, Q.(2018). Asymmetric Expression of LincGET Biases Cell Fate in Two-Cell Mouse Embryos. Cell 175, 1–15.
BioArt,一心关注生命科学,只为分享更多有种、有趣、有料的信息。关注请长按上方二维码。投稿、合作、转载授权事宜请联系微信ID:bioartbusiness 或邮箱:sinobioart@bioart.com.cn
阅读原文微信扫一扫关注该公众号






