- 前言 -
喜讯不断,欧易生物客户又发 JCI 文章。
前几天才给大家分享了复旦大学王建华教授发表的一篇 JCI 文章,上周欧易客户又一篇 JCI 文章在线发表。让我们一起来看一下文章的主要内容。
基本信息
论文题目:Long noncoding RNA Bmncr regulates mesenchymal stem cell fate during skeletal aging
发表期刊:The Journal of Clinical Investigation
发表时间:2018.10
影响因子:13.251
通讯作者为罗湘杭教授,李长俊特聘研究员、肖业博士、杨觅博士为共同第一作者。
本文涉及的高通量技术:基因芯片(Affymetrix mouse 1.0 gene ST array)由欧易生物提供服务
研究背景
在局部微环境和分子介质的影响下,骨髓间充质干细胞(Bone marrow mesenchymal stem cells, BMSCs)可以分化成多种成熟的细胞类型,包括脂肪细胞和成骨细胞。老年性骨质疏松症的特点即为骨髓腔室中骨形成的减少以及脂肪的积累。尽管已知随着年龄的增长,BMSCs会更加趋向于分化成脂肪细胞,但其机制目前尚不清楚。近年来,长非编码RNA(lncRNAs)被发现在多种疾病和生物学进程中发挥重要作用,例如细胞增殖、分化、凋亡,基因的调控以及肿瘤的发展。部分lncRNAs是通过辅助关键转录因子与启动子结合以及其与转录因子自身的物理联系调控基因的表达。而目前关于老年性骨质疏松症中lncRNAs的作用的研究还很少。
研究内容
BMSCs在成骨和成脂命运中呈现出年龄相关的谱系分化,即趋向于骨质流失和脂肪生成。本研究利用基因芯片发现一种关键lncRNA分子Bmncr,在整个过程中调节BMSCs的命运。Bmncr敲除的小鼠表现出骨质疏松症样的表型;而过表达小鼠的Bmncr会刺激小鼠的骨生成,减少骨髓脂肪。Bmncr通过上调细胞外基质中的纤调蛋白(FMOD)将BMSCs锚定于骨小梁富集的干骨后端,同时激活BMSCs中的BMP2通路。Bmncr还可以作为支架促进TAZ和ABL的装配,促进TAZ和RUNX2、PPARG转录复合体的形成,从而促进成骨抑制成脂。此外,在人BMSCs中恢复BMNCR的水平可以改变成骨-成脂分化模式。以上结果表明,Bmncr是衰老相关的成骨微环境改变及BMSCs谱系分化的关键调控因子。
研究思路
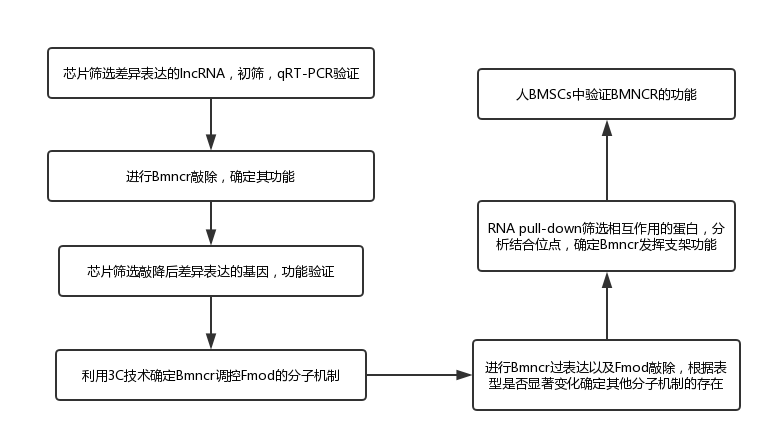 图 | 技术框线示意
图 | 技术框线示意
研究结果
1. 衰老过程中BMSCs的Bmncr表达下调
利用Agilent lncRNA芯片检测的不同年龄的小鼠的BMSCs,一共筛选到92个差异表达的lncRNA (fold change>3, FDR<0.2),其中有83种lncRNA伴随着年龄的增长呈表达下调(见图 1A)。之后按照严苛的筛选条件筛出5种lncRNA,NONMMUT002667是保守程度最高的一种,且在成骨细胞中高表达,被命名为Bmncr。用qRT-PCR技术验证了它的表达水平变化(见图 1B),并且在人BMSCs中也检测到了同样的表达变化趋势(见图 1C, D)。
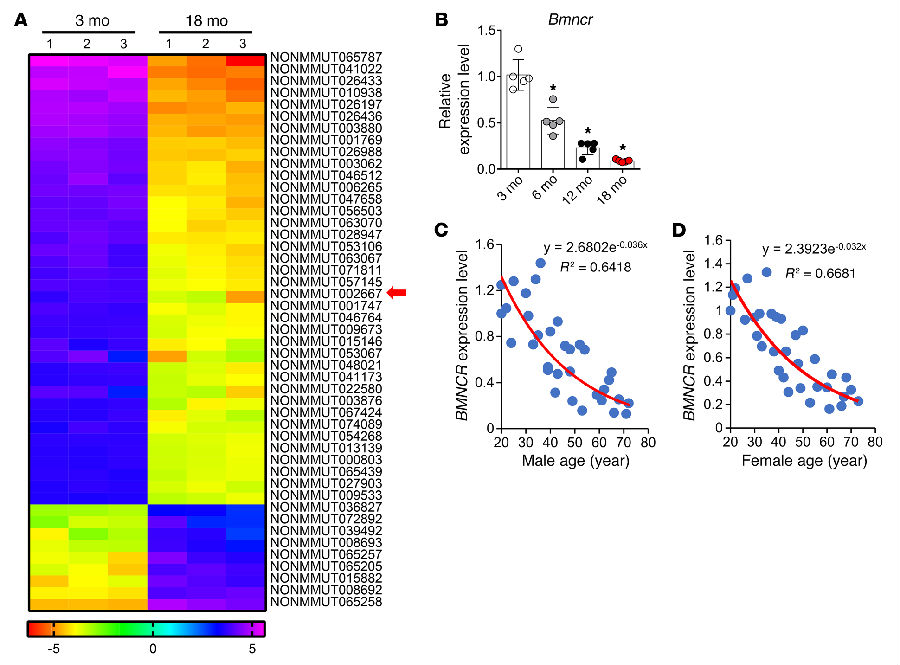
图 1|衰老过程中BMSCs的Bmncr表达下调
2. Bmncr-KO小鼠呈现骨质流失以及骨髓脂肪积累
通过基因打靶技术获得了Bmncr敲除的一批小鼠,分别分析了不同年龄阶段的小鼠的骨密度、松质骨体积以及皮质骨厚度,发现同对照组相比,Bmncr-KO小鼠这3个指标均下降(见图2A, B)。而且Bmncr-KO小鼠中的骨形成率以及骨表面表达骨钙蛋白的成熟成骨细胞数量也显著降低(见图 2E, G)。与此同时Bmncr-KO小鼠脱钙股骨中脂肪细胞和脂肪滴的数量明显上升(见图 2I)。
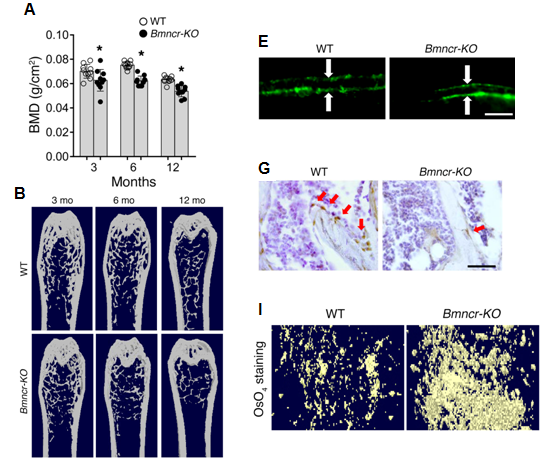
图 2|Bmncr-KO小鼠呈现骨量减少以及骨髓脂肪积累
A.不同年龄阶段的小鼠的骨密度; B. 股骨中松质骨体积及皮质骨密度; E. 骨形成率; G. 股骨远端的成骨细胞数量变化; I. 脱钙股骨OsO4染色结果
3. Bmncr调节骨髓中BMSCs的成骨微环境
Bmncr-KO小鼠干骨后端的多潜能BMSCs变少,但在中央骨髓处增多,这一结果暗示了Bmncr的敲降可能影响到了BMSCs在骨形成微环境中的粘附能力。为了找出其中的机制,利用 Affymetrix mouse 1.0 gene ST array 基因芯片技术检测了Bmncr-KO小鼠中的BMSCs中的表达谱(见图 3A)。结果显示有多个胞外基质蛋白编码基因发生了下调,以编码纤调蛋白的基因Fmod下调最为显著。构建Fmod-KO转基因小鼠,发现Fmod基因在不同器官中的表达模式和Bmncr相同。分离BMSCs细胞进行体外细胞粘附试验发现Fmod敲除后细胞粘附性变弱(见图 3B),暗示了Bmncr可能通过Fmod调节BMSCs粘附于骨表面的能力。
研究还发现多种骨生成基因在Bmncr被敲除后发生了表达水平的下调。其中BMP2基因下调显著,且其信号通路的活跃性也发生了降低(见图 3D)。Bmncr可能的调控成骨微环境的基质如图3E所示。
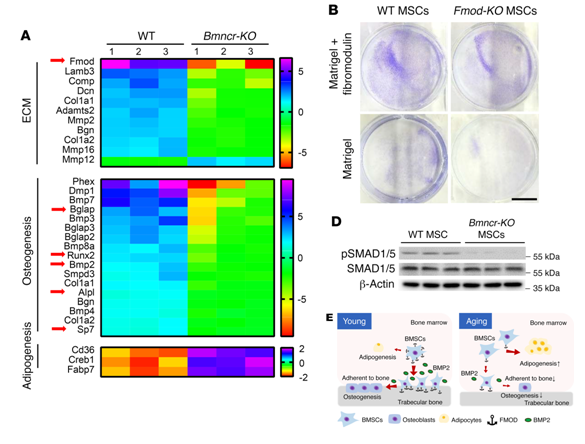
图 3|Bmncr通过FMOD和BMP2通路调控BMSCs的成骨微环境
A. 表达谱芯片结果; B. 细胞粘附实验结果; D. BMP2通路激活状况; E. Bmncr通过FMOD和BMP2通路调控BMSCs的成骨微环境可能的机制模型
4. Bmncr调节Fmod的转录以及局部的3D染色质结构
研究发现Bmncr可以不通过BMP2直接影响Fmod的表达,在分析了它们的空间位置后发现Bmncr位于Fmod上游大约30 kb,处于Fmod的启动子和增强子之间(见图 4C, D)。利用染色质构象捕获技术(3C)发现Bmncr被敲降后,2个距Fmod的较近的增强子同启动子的相互作用减弱(见图 4E),机制如图 4F所示。
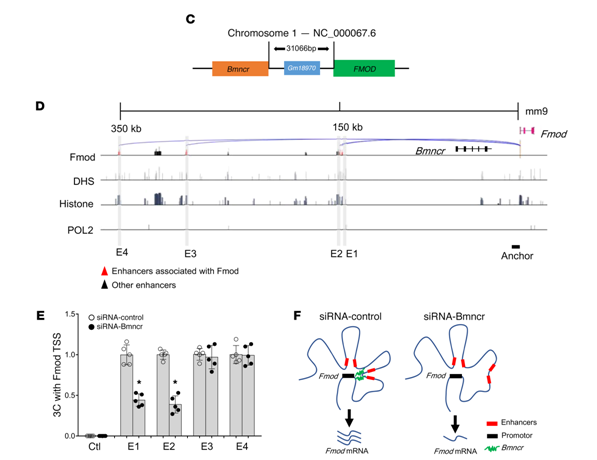
图 4|Bmncr调节Fmod的转录以及局部的3D染色质结构
C.Bmncr和Fmod位置示意图; D. Fmod启动子和增强子的位置示意图; E. 3C结果图; F. 3D水平上Bmncr敲降后发生的局部结构变化模型示意图。
5. Bmncr在ABL和TAZ装配中发挥支架作用
在Bmncr过表达的转基因小鼠中敲除Fmod仅仅可以使部分表型向野生型变化,这暗示了Bmncr可能通过其他信号通路调控骨重。使用RNA pull-down技术获得了可与Bmncr结合的蛋白并进行了质谱分析,并根据已有文献选择TAZ和ABL1进行后续的研究(见图 5A)。利用免疫印迹和qRT-PCR从两个层面证明了Bmncr可以同时同ABL1和TAZ结合,并找出了结合的位置(见图 5 B-D)。之后还发现在Bmncr被敲降的情况下TAZ同ABL1以及TAZ同RUNX2和PPARG的结合均被削弱,表明Bmncr在其中起到了支架的作用(见图 5E, F)。
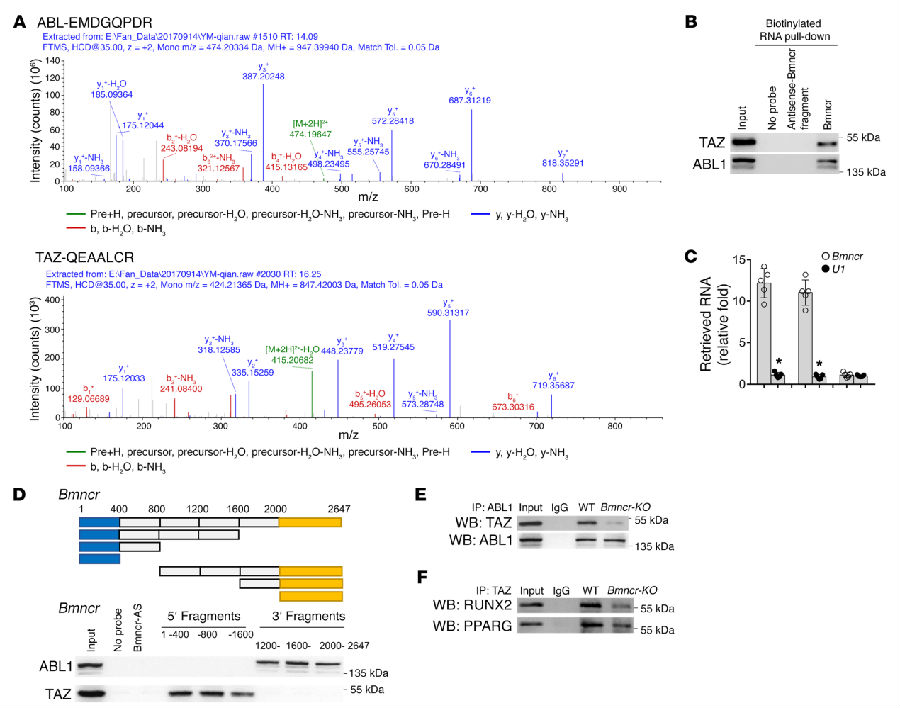
图 5|Bmncr在ABL和TAZ装配中发挥支架作用
A. 质谱图结果; B. 免疫印迹结果; C. qRT-PCR结果; D. 利用一系列Bmncr的缺失突变体确定结合位置; E. 敲除Bmncr后对TAZ与ABL1相互作用的影响;F. 敲除Bmncr后对TAZ与RUNX2、PPARG相互作用的影响
6. 人BMSCs中BMNCR水平的恢复逆转了成骨-成脂分化的年龄相关开关
最后本研究在人BMSCs中测试了人BMNCR的功能。以年老病人体内分离出的BMSCs作为样本,转染BMNCR后在不同诱导分化条件下培养细胞,并对某些标记基因的表达水平进行了检测(见图 6 A-F),发现其确实可以促进成骨分化抑制成脂分化。
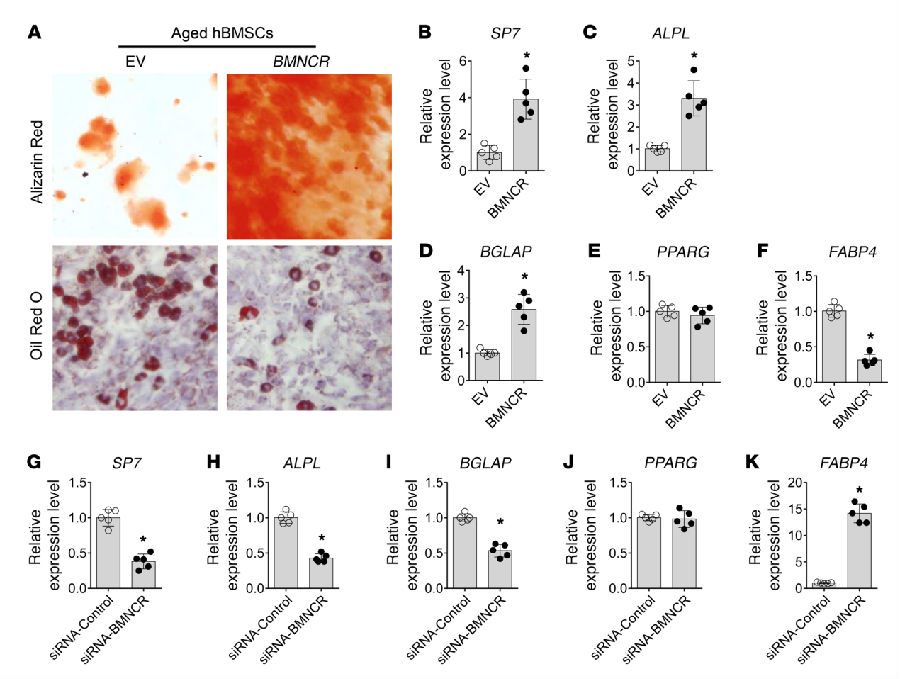
图 6|BMNCR促进人BMSCs的成骨分化,抑制成脂分化
总结
本研究先利用基因芯片得到一系列发生变化的lncRNA,并利用体内实验证明了经过严格筛选的lncRNA Bmncr有着影响BMSCs分化方向的功能。之后进行了一系列严谨的功能实验挖掘出分子机制。此过程中不仅分析了基因表达水平的变化以及是否与功能有联系,还以Fmod和Bmncr的距离为入手点,找到lncRNA在3D层面发挥作用的机制。文章不仅确定了Bmncr是衰老相关的成骨微环境改变及BMSCs谱系分化的关键调控因子,其较为严谨的思路也为之后类似的研究提供了一个比较好的模板。
参考文献
Li CJ, Xiao Y, Yang M, et al. Long noncoding RNA Bmncr regulates mesenchymal stem cell fate during skeletal aging. The Journal of Clinical Investigation 2018. DOI: 10.1172/JCI99044
END
本文系欧易生物原创
转载请注明本文转自欧易生物







