今日文章
m(6)A modulates haematopoietic stem and progenitor cell specification.
摘要
本文通过对斑马鱼与小鼠的实验分析,首次揭示了m6A mRNA甲基化修饰在脊椎动物造血干细胞分化中的调控机制
基本信息
材料:斑马鱼胚胎/小鼠
主要技术:MeRIP-seq,RNA-seq,miCLIP–seq,MS
期刊:Nature
影响因子:40.1
什么是m6A?
m6A(N6-甲基腺嘌呤)是最常见、最丰富的真核生物mRNA转录后修饰形式之一。该修饰过程是动态可逆的,并由甲基转移酶复合体(METTL3,WTAP和METTL14组成)、去甲基酶(FTO和ALKBH5)和相应的阅读器(YTHDF或YTHDC等)协同调控。目前,m6A的生物学功能已备受关注,并成为生命科学热门研究领域之一,Nature杂志连续发文报道了m6A在斑马鱼早期发育、果蝇性别决定以及T细胞稳态中的功能。自此,我们对于m6A修饰已经有了初步了解和认识,但是,该修饰的生物学功能以及其作用机制仍有待深入探索和挖掘。
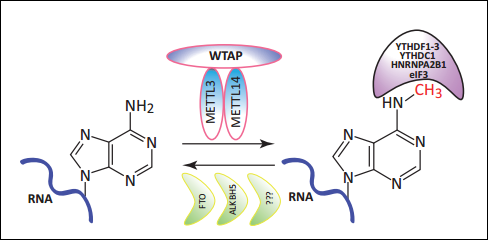
图1 | m6A示意图
什么是HSPCs?
造血干细胞在一定的微环境和某些因素的调节下,增殖分化为各类血细胞的祖细胞,称造血祖细胞(hematopoietic progenitor cells,HPCs),它也是一种相当原始的具有增殖能力的细胞,但已失去多向分化能力,只能向一个或几个血细胞系定向增殖分化,故也称定向干细胞(committed stem cell),合并称为haematopoietic stem/progenitor cells(HSPCs)。血液系统中的成熟细胞寿命极短,因此在人的一生中,造血干细胞需要根据机体的生理需求适时的补充血液系统各个成熟细胞组分。同时在损伤、炎症等应激状态下,造血干细胞也扮演着调节和维持体内血液系统各个细胞组分的生理平衡的角色。
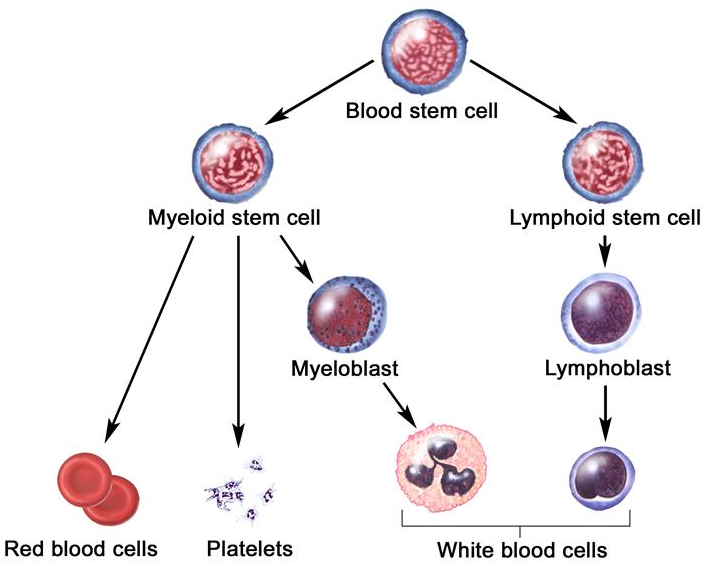
造血干细胞分化简图
研究思路
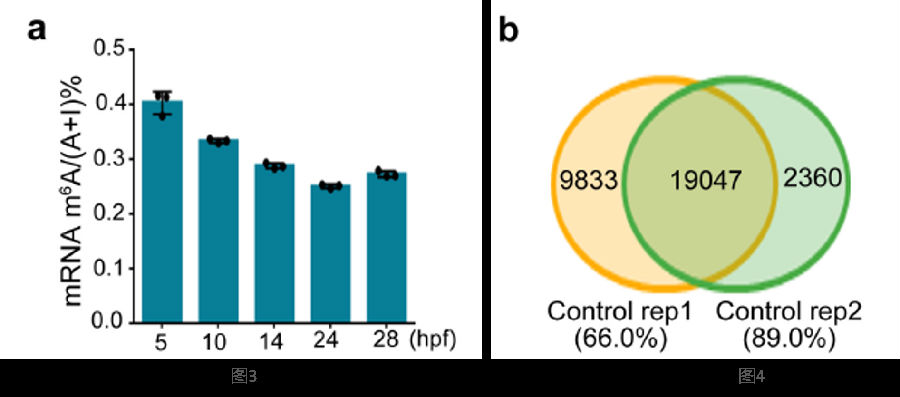
实验选材为斑马鱼胚胎期细胞,从受精开始经过5-28hours(5-28hpf)进行五次取样,通过质谱法(MS)检测样品中的甲基化程度,发现了高度的RNA甲基化表达。
(图3)在28hpf样品,最早的造血干细胞(HSPCs)开始出现时,利用MeRIP-seq技术在两个独立control样品中检测到了高度重合的m6A峰(图4)(使用MACS2软件进行call peak)
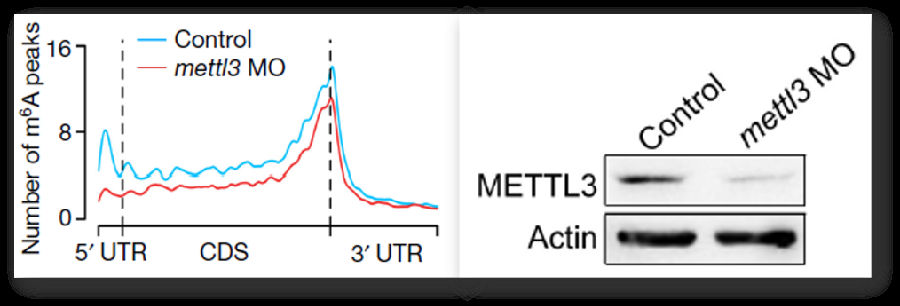
将实验组样品通过mettl3 morpholino处理,与control组进行差异比较,发现了m6A peak数量的明显下降与mettl3的低表达。
甲基化水平显著下调的4593个基因被确认为潜在的mettl3靶基因(下左),胚胎发育相关GO在这些基因中显著富集,暗示了mettl3在细胞发育中的作用(下右)
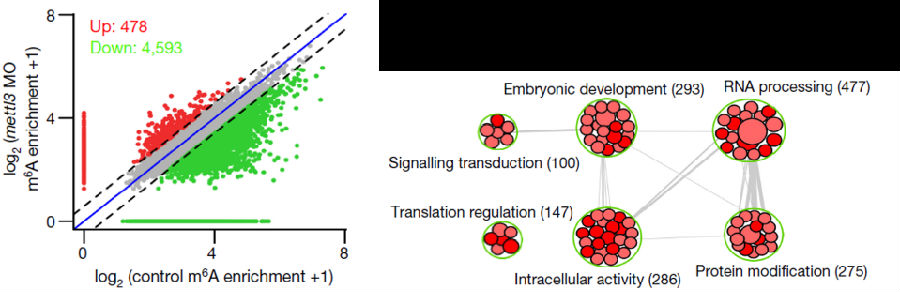
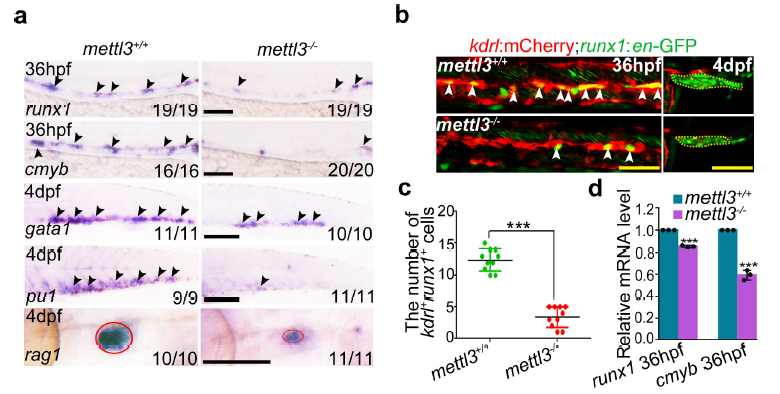
但是在MO样品中,原始造血功能并没有受到显著影响(下左),与此同同时,HSPC表达标记的runx1与cmyb均有明显下调,MO中HSPC的后续分化也有受到影响(下右)

通过GFP染色后的胚胎成像发现生血内皮细胞和HSPC显著减少,导致4dpf胸腺T淋巴细胞的减少(下左),示踪影像显示MO内皮细胞未完成向HSPC的转化(下右)。
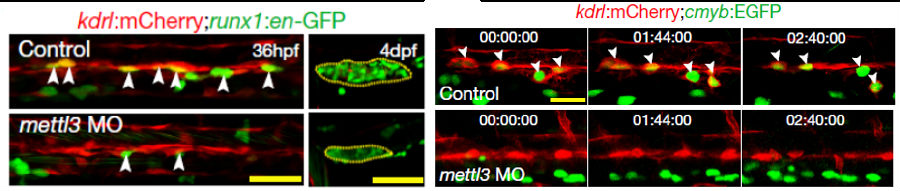
MO中内皮细胞相关标志物的水平也有明显提高
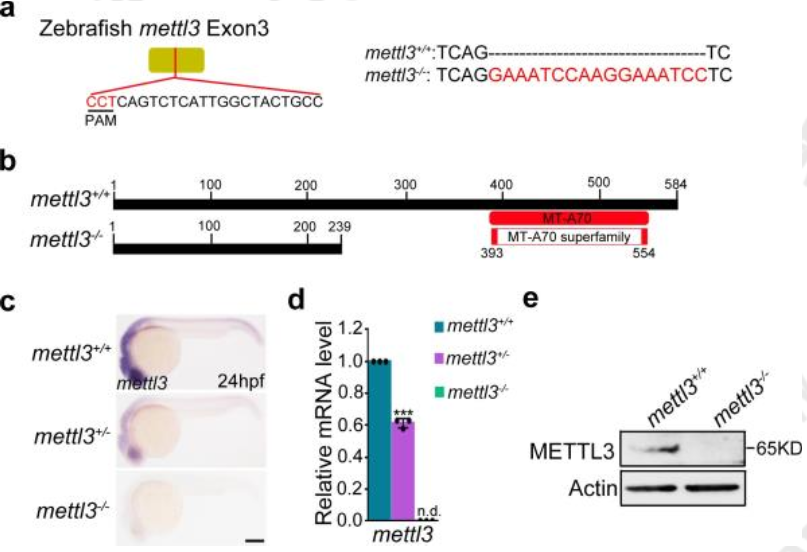
为了进一步验证mettl3在HSPC发育中的作用,设置了一个mettl3敲除实验组来进行差异分析,同样的,敲除mettl3的样品表现出了同样的表型
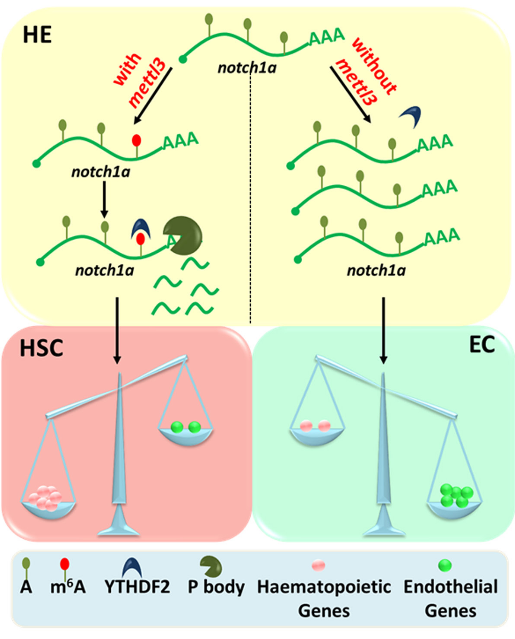
通过参考文献的结论——在内皮-造血转化(EHT)期间激活notch1a信号可以抑制HSPC转换推测m6A作为变阻器在生化反应中起作用。
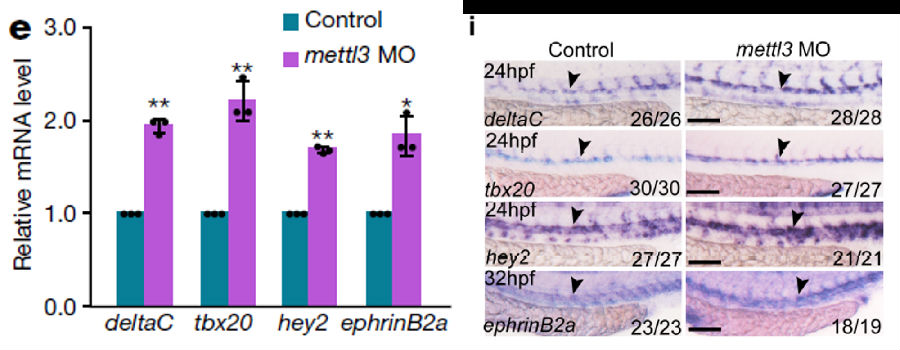
以notch1a作为目标信号进行示踪,发现MO样品的notch1a甲基化基本消失(生血内皮)
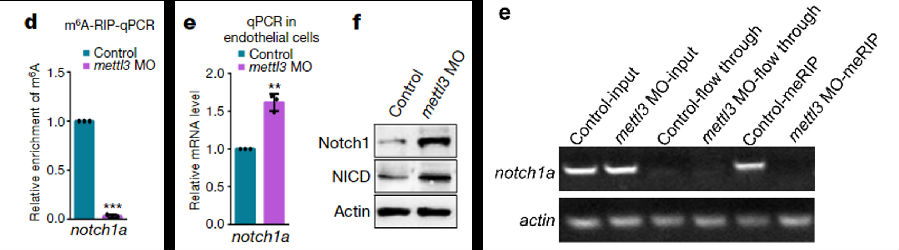
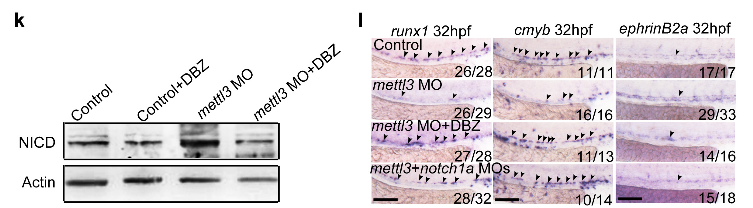
为了证明notch1a在HSPC转化过程中的作用,使用DBZ抑制剂进行验证,发现添加抑制剂的MO组恢复了HSPCs的正常转化
段落结论
mettl3介导的m6A修饰通过抑制notch1a来调节HSPCs转化过程。
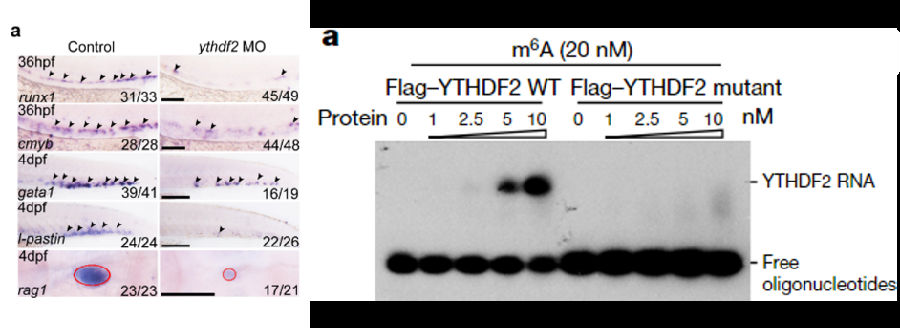
在mettl3后,对ythdf2(m6A reader)进行相同条件的分析,获得了一致的结论,包括HSPC标志物runx1和cmyb低表达(下左)以及m6A结合丢失(下右)等
为了验证这个过程是否在小鼠中同样保守存在,对小鼠进行同一条件的实验验证,获得了一致结果(图略)。
至此,完整提出本篇文章的最终结论:
m6A在脊椎动物多功能干细胞分化机制中起到不可替代的调节/平衡作用。
m6A调控下的HSPCs形成示意图
- END -
苜蓿 撰文
本文系欧易生物原创
转载请注明本文转自欧易生物







