
https://doi.org/10.1038/s41586-018-0235-7
来自于MIT、Dana-Farber癌症研究所的科学家们以小鼠为模型发现,消瘦是因为原本负责促进食物消化的胰腺酶减少了。当研究人员利用替代酶治疗这类小鼠时,他们意外发现,虽然这些小鼠体重增加了,但是寿命并没有比未接受治疗的患癌小鼠长。
饥饿模式
早在2014年,文章作者、MIT的生物学副教授Matt Vander Heiden和团队就已发现,胰腺癌患者的肌肉会发生衰退,而且比其他病症出现的时间要早得多。
科学家们对这种组织衰退发生的原因一直没有定论,其中有一种假说认为,胰腺肿瘤过度表达某种信号因子,例如激素,它会在血液中循环,促进肌肉、脂肪的分解。
然而,在最新的研究中,科学家们发现事实并非如此。相反,他们发现,即便是非常微小的早期胰腺肿瘤也会破坏关键消化酶的表达。对于患有早期胰腺癌的小鼠而言,即便吃的食物与正常小鼠一样多,它们也会因为无法消化所有的食物而进入饥饿模式,从而身体会开始分解其他组织,特别是脂肪。
科学家们发现,当他们将胰腺肿瘤细胞植入身体其他部位,小鼠体重不会减轻。这表明,胰腺肿瘤细胞并没有过度表达循环于血液的“减肥因子”。只有位于胰腺组织,癌变细胞才会引发体重的下降。

ISTOCK, DR_MICROBE
消瘦与生存率无关?
逆转这一“饥饿模式”是否能够提高患者的生存率?研究团队希望找到答案,他们通过补充替代酶扭转了患癌小鼠的体重下降的趋势,但是,这些小鼠的寿命却没有延长。
这一结果让研究团队很惊讶,但是它与限制热量能够降低癌症和其他疾病风险的小鼠研究一致。
Vander Heiden进一步解释:“事实证明,这种组织衰退机制实际上可能发挥着保护作用,至少小鼠试验是这样的,与限制卡路里保护小鼠健康是一样的。”
仍待临床研究
这一系列动物试验促使研究团队挖掘体重减轻与人类癌症患者生存之间的关联。他们分析了782个癌症患者的血液样本和病例数据,结果并没有找到组织衰退和存活之间的联系。但这一发现很重要,因为它可以让患者放心:体重下降并不意味着病情加重。
“有时候,患者对消瘦毫无办法。现在,这一新研究可能意味着,仅仅因为吃得少,体重下降,并不一定就是活不长久。” Vander Heiden解释道。
Vander Heiden强调:“这项研究局限于动物试验,还需要投入更多的临床试验进行验证,以确定他们在小鼠身上发现的机制是否同样适用于人类癌症患者。”而且,鉴于胰腺肿瘤的特殊性,它可能与其他类型的癌症以及艾滋病等引发的组织消耗机制不同。
另一篇研究:胰腺细胞尺寸与寿命长短呈负相关

DOI: https://doi.org/10.1016/j.devcel.2018.05.024
6月18日,《Developmental Cell》期刊上新发表一项研究揭示了胰腺细胞的又一特殊性:哺乳动物的胰腺细胞大小与寿命有关。
来自于以色列-加拿大医学研究所、希伯来大学Hadassah医学院的发育生物学家Yuval Dor和团队以小鼠为模型发现,相比于成年小鼠,他们需要更高的放大率观察幼鼠的胰腺细胞,这意味着,这些细胞的体积在增大。
这与人类不同——出生后,人胰腺细胞大小没有变化,但是数量在增加。这表明,成年细胞的尺寸相对较小,并不比婴儿的胰腺细胞大。
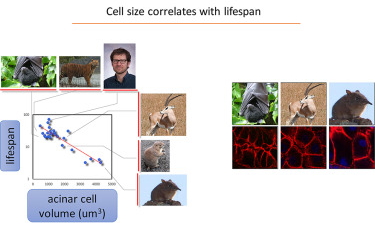
图片来源:Developmental Cell
这些差异让Yuval Dor团队分析了24种不同哺乳动物的成熟胰腺组织。他们发现,较大的胰腺细胞与更短的寿命有关,而较小的细胞则与更长的寿命有关。举例来说,小鼠的胰腺细胞更大,寿命一般只有3年,而同样大小(身体)的果蝠、裸鼹鼠的胰腺细胞更小,寿命分别达到25岁和30岁。
“我们尚未找到原因。” Yuval Dor表示道,但是他们推测,相比于复制, 细胞生长可能更会促进小鼠提前进入繁殖期,而代价就是加快衰老。
责编:悠然
参考资料:
Biologists discover how pancreatic tumors lead to weight loss
Pancreatic Cell Size Negatively Relates to Lifespan in Mammals







