中科新生命,成立于2004年,专注于质谱技术方法在科技服务、生物医药、精准医疗领域的应用开发。12年质谱服务经验,每年处理样本数超万例,通过与中科院的技术合作及企业研发团队的自主创新,致力成为您最具价值的生物技术合作伙伴。
先进平台:基于最优化的质谱平台,项目运行畅通无阻
专业服务:全博士售前团队,专业项目售后,数据发表负责到底
经常会有客户打来电话问关于IP或者Pull down实验方面的问题,简直就可以写成一部“两个分子之间的生死爱恋史”。今天特意整理了其中常见的六大问题,与君共勉。
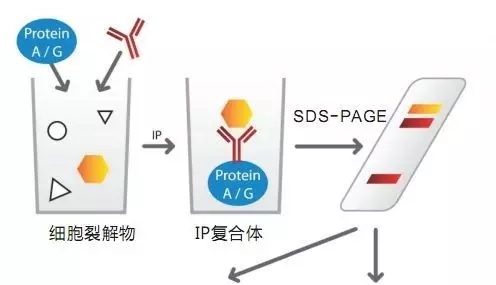
Q:哪种样本更为合适? 选择溶液还是SDS-PAGE胶条作为质谱检测的样品?
理论上两者都可以,但具体情况请参照下面备注A-F。
A:建议客户无论是送溶液还是胶条到公司之前,都先进行SDS-PAGE,考染可见清晰条带,这一步主要是检测样品数量和质量;
B:如果发现与阴性对照相比,正常组有明显差异的条带,客户可以直接切取差异条带进行检测;
C:如果客户之前有其他实验初步判定目的蛋白,那么可以在凝胶中根据目标蛋白的分子量切取胶条进行检测;
D:溶液样品可能含有高丰度抗体干扰,如要去除建议切胶,但可能缺失与抗体位置相同的蛋白;如果经费允许,可以分成两份样品(高丰度抗体条带+其他条带)进行检测;
E:IP样品请标明是否已洗脱或者含有beads,否则会影响处理方式;
F:液体样品请标明液体buffer,尤其是已加入SDS或者其他去垢剂建议切胶。
Q:是否一定会检测到客户的bait(诱饵)蛋白?
不一定,不要以为是我的技术不行,这就是现状。
原因:
A:客户在western实验中观察到的诱饵蛋白,是通过级联放大后观察到的。质谱检测没有级联放大效果,有可能诱饵蛋白的富集效果不显;
B:如果用的是诱饵蛋白自身的抗体结合beads,在IP或者pull-down实验前需检测下抗体的特异性,建议最好使用生物体自身提取的蛋白检测,而不仅仅是用原核生物表达纯化的蛋白检测;
C:诱饵蛋白本身蛋白酶酶解效果不好或者带电能力差也会影响质谱检测效果;
D:是否是抗体的高丰度信号的抑制作用(高丰度的抗体信号会影响低丰度蛋白的检测)。
Q:IP-MS结果中有很多蛋白,怎样挑选与诱饵蛋白互作可能性比较高的蛋白?
从质谱角度很难确定互作可能性较高的蛋白,但是可以根据蛋白的数量以及丰度大概推测该IP样品中含有的主要成分。
Q:IP-MS, pull-down-MS是否可以直接检测互作蛋白的修饰位点?
可以同时检索修饰数据库,但是不代表这两个蛋白一定具有修饰关系(修饰关系必须有体内体外的酶学生化反应实验证实)。一般检测修饰位点的结果不会很理想,检测到的修饰蛋白数目会很少。一是翻译后修饰蛋白的丰度比较低,二是修饰蛋白和总蛋白比起来量非常少 ,由于高丰度蛋白(未修饰蛋白)对低丰度蛋白 (修饰蛋白)有抑制作用,所以检测到的数目会很少。
Q:IP-label free技术洗脱液选择?
建议酸洗脱或者竞争性洗脱。
一是由于变性剂洗脱会将高丰度抗体蛋白洗脱下来,这些抗体蛋白会对低丰度蛋白的检测有很大影响,二是由于IP后的溶液蛋白量会比较少,可能需要2-3个IP后的溶液混在一起才有足够的样品量,因此样品体积可能比较大,后期实验需要采用特殊的酶解方式,且不能含有变性剂。
注意:
IP实验本身平行性就很不好,一般情况下不提倡后续做label free定量。
Q:需不需要做对照?
重要的事情说三遍,一定要有阴性对照,一定要有阴性对照,一定要有阴性对照!
以上就是两个分子之间的爱恋总结,看完之后你有没有学到几招呢?
如果有所收获的话,记得多多转发和点赞哦~
中科新生命 · 质谱系统解决方案领跑者
▼
生物医药结构确证
蛋白质组 - 修饰蛋白质组 - 代谢组 - 脂质组
▼
技术支持

公众号 · 行业动态

www.aptbiotech.com T: 021-54665263
E: info_apt@sibs.ac.cn Q: 1875681852







