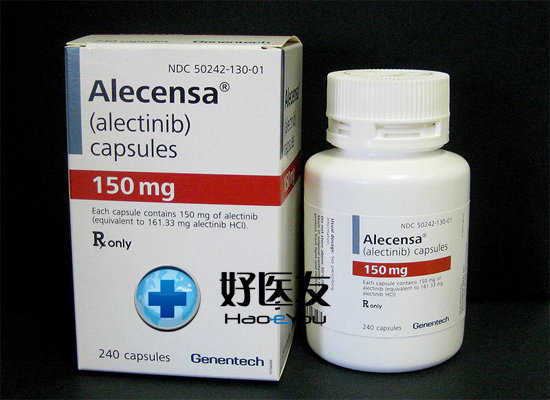
2015年12月11日,美国FDA批准阿雷替尼胶囊Alecensa(alectinib)用于治疗晚期(转移性)ALK阳性非小细胞肺癌,适用于经另一种治疗药物-克唑替尼治疗后恶化或不对其耐受的患者。
FDA的药品评价和研究中心中血液学和肿瘤学主任说:“今天的批准为一组患者一旦他们的疾病用Xalkori治疗不再响应提供一种新治疗选择,” “Alecensa临床试验提供证据除了对在肺中肿瘤主要作用外,对已播散至脑肿瘤作用,这是对临床医生要了解的重要效应。” 加快审批,突破性治疗指定,优先审评状态和孤儿药物指定
两项单臂临床试验证实了Alecensa的安全性与有效性。这两项临床试验的受试者都是不再对克唑替尼治疗敏感的转移性ALK阳性NSCLC患者,他们接受了一天两次的口服Alecensa治疗。第一项临床试验有38%的患者达到了NSCLC肿瘤部分缩小,且疗效平均持续了7.5个月。第二项临床试验有44%的患者达到了NSCLC肿瘤部分缩小,且疗效平均持续了11.2个月。这两项临床试验还评估了Alecensa对患者的脑内转移瘤的疗效。在具有可测量的脑内转移瘤的受试者中,有61%的受试者达到了脑内转移瘤完全消失或部分缩小,且疗效平均持续了9.1个月。
ALECENSA是一个激酶抑制剂适用为的治疗有间变性淋巴瘤激酶(ALK)-阳性,转移非小细胞肺癌(NSCLC)进展对或是对克里唑蒂尼耐受的患者的治疗。这个适应证是在加快审批下被批准根据肿瘤反应率和反应时间。继续批准这个适应证可能取决于在验证性试验中临床获益的验证和描述。
剂量和给药方法
600 mg口服每天2次。与食物给予ALECENSA。
剂型和规格
胶囊:150 mg
禁忌证
无。
警告和注意事项
⑴ 肝毒性:监视肝实验室测试每2周治疗的头2个月期间,和任何治疗期间定期。严重ALT,AST,或胆红素升高情况中,不给,然后减低剂量,或永久地终止ALECENSA。
⑵间质性肺病(ILD)/肺炎:0.4%患者发生。被诊断ILD/肺炎患者立即不给ALECENSA和如已确定没有ILD/肺炎的其他潜在原因永久地终止。
⑶心动过缓:常规地监视心率和血压。如症状性,不给ALECENSA然后减低剂量,或永久地终止。
⑷严重肌痛和肌酸磷酸激酶(CPK)升高:发生分别在1.2%和4.6%患者。治疗的头一个月期间每2周评估CPK和在患者报告不解释肌痛,触痛,或乏力。在严重CPK升高情况中,不给,然后恢复或减低剂量。
⑸胚胎胎儿毒性:ALECENSA可能致胎儿危害。忠告有生殖潜能女性对胎儿潜在风险和使用有效避孕。
不良反应
最常见不良反应(发生率≥20%)是疲乏,便秘,水肿和肌痛。
报告怀疑不良反应,联系Genentech电话1-888-835-2555或FDA电话1-800-FDA-1088或www.fda.gov/medwatch。
特殊人群中使用
哺乳:不要哺乳喂养。
好医友用药咨询可拨打4008860922详询