本文转载自“博雅干细胞”,作者:Dr.韦
老年痴呆、帕金森、肌肉萎缩……间充质干细胞给这些疾病的治疗带来新的希望。多项人体临床试验表明,未来间充质干细胞有望成为神经退行性疾病治疗的有效工具。
近年来,随着老龄化加剧,神经退行性疾病患病率节节攀升。尽管在过去的几十年中,科学家们在神经退行性疾病的治疗领域作出了巨大的努力,但仍然未找到有效的治疗方法。
首先,尽管这些疾病的病因被证明与多种细胞和分子机制有关,但科学家们尚未弄清楚神经元死亡的原因,并且没有单一的分子途径能够调节疾病的发展。其次,对于大多数疾病患者,由于缺乏有效的生物标志物,早期诊断受到了阻碍。第三,神经元退变的发展常常带来继发性影响,如慢性炎症等。另外,进入中枢神经系统的药物应能穿过脑血屏障,以及靶向不同中枢神经系统区域的特定细胞类型,这就需要高效地、能够将药物送达至目标位置的载体。
受以上因素的影响,传统的神经退行性疾病治疗研究并未取得理想的效果,而随着间充质干细胞临床研究和人体试验的开展,神经退行性疾病的治疗迎来了新机遇。
人体临床试验汇总
过去十年的多个报告显示,在多种啮齿类动物模型中,间充质干细胞移植后能够改善多种神经退行性疾病或急性脑损伤。间充质干细胞移植可提高存活率,减少病理,缓解认知功能衰退。
随着在模型动物试验中不断取得积极进展,越来越多的人类临床试验采用间充质干细胞,目的是缓解神经变性和治疗急性脑损伤以及其他疾病。截止目前,clinicaltrials.gov登记注册的人类间充质干细胞临床试验有600多项,其中超过40项进入了III期临床。
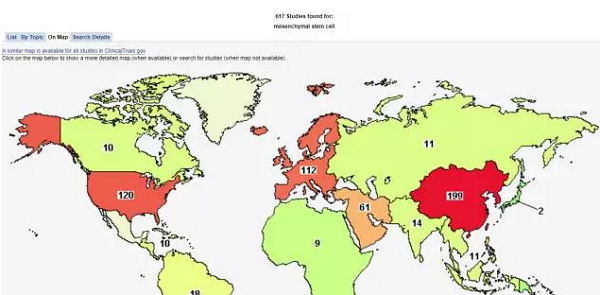
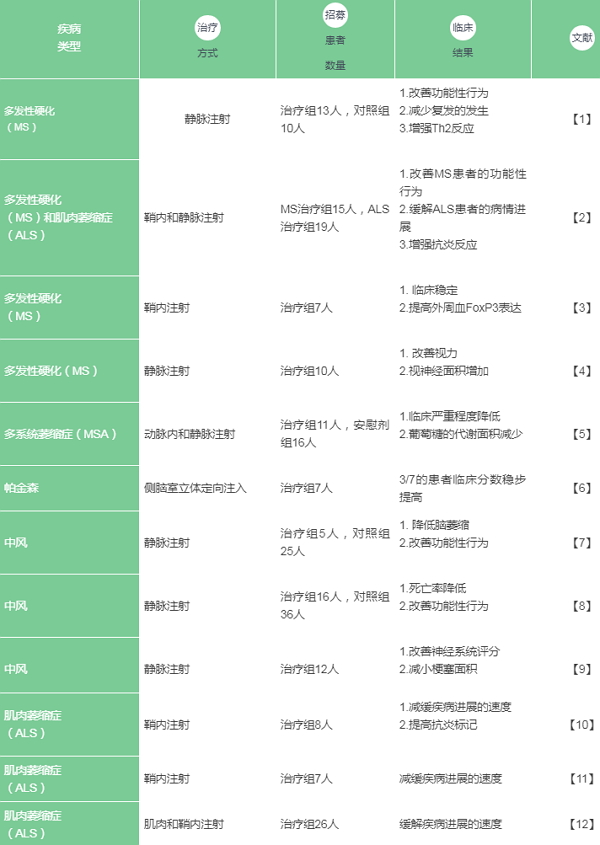
在此,我们汇总了使用人类间充质干细胞治疗神经退行性疾病的人体临床试验,以及所获得的临床结果。
为什么间充质干细胞能用于神经退行性疾病的治疗?
利用干细胞来治疗神经退行性疾病,目的是通过再生和为受损组织提供局部支持,以阻止疾病的临床恶化。
基于可以有效地从成人组织中获取、体外扩增培养以及能够安全的自体移植,间充质干细胞在细胞治疗中极具潜力。
间充质干细胞已被证明能够向神经系统分化,并分泌一系列能够促进神经组织维持和修复的因素。此外,间充质干细胞还被证明具有移植后归巢至损伤区域的能力,这意味着它们作为治疗药物载体十分具有前景。
科研人员认为,利用间充质干细胞作为载体将治疗药物递送至病变区域,可为多种神经退行性疾病的靶向治疗提供有效的平台。
事实上,已有很多报道显示,当间充质干细胞移植至神经退行性疾病啮齿类动物模型时,它能够带来很多有利的效应,如神经营养因子介导的保护、增强神经的形成、炎症的调节、异常蛋白质聚集体的清除。
结语
神经退行性疾病包括神经元功能的衰退、脑萎缩,并且常常与蛋白质异常沉积有关。虽然多种神经退行性疾病,如阿尔兹海默症(AD)、帕金森(PD)、亨廷顿病(HD)、肌肉萎缩症(ALS)、多系统萎缩症(MSA)发生在大脑的不同区域以及拥有不同的病因,但累积数据表明,它们拥有共同的细胞和分子机制。
大多数神经退行性疾病表现出了复杂的病因,间充质干细胞的多重益处似乎针对这些疾病的不同因素。了解这些细胞发挥功能的分子机制,有助于推进间充质干细胞治疗神经退行性疾病的进展。
参考文献:
【1】 Li J-F, Zhang D-J, Geng T et al. The potential of human umbilical cord-derived mesenchymal stem cells as a novel cellular therapy for multiple sclerosis. Cell Transpl 2014;23:113–122. doi:10.3727/096368914X685005.
【2】 Buckner JH. Mechanisms of impaired regulation by CD4+CD25+FOXP3+ regulatory T cells in human autoimmune diseases. Nat Rev Immunol 2010;10:849–859. doi:10.1038/nri2889.
【3】 Mohajeri M, Farazmand A, Mohyeddin Bonab M et al. FOXP3 gene expression in multiple sclerosis patients pre- and post mesenchymal stem cell therapy. Iran J Allergy Asthma Immunol 2011;10:155. 61. doi:010.03/ijaai.155161.
【4】Connick P, Kolappan M, Crawley C et al. Autologous mesenchymal stem cells for the treatment of secondary progressive multiple sclerosis: An open-label phase 2a proof-of-concept study. Lancet Neurol 2012;11:150–156. doi:10.1016/S1474-4422(11)70305-2.
【5】 Park H-J, Shin JY, Lee BR et al. Mesenchymal stem cells augment neurogenesis in the subventricular zone and enhance differentiation of neural precursor cells into dopaminergic neurons in the Substantia Nigra of a Parkinsonian model. Cell Transplant 2012;21:1629–1640. doi:10.3727/096368912X640556.
【6】 Venkataramana NK, Kumar SKV, Balaraju S et al. Open-labeled study of unilateral autologous bone-marrow-derived mesenchymal stem cell transplantation in Parkinson's disease. Transl Res2010;155:62–70. doi:10.1016/j.trsl.2009.07.006.
【7】 Bang OY, Lee JS, Lee PH et al. Autologous mesenchymal stem cell transplantation in stroke patients. Ann Neurol 2005;57:874–882. doi:10.1002/ana.20501.
【8】 Lee HJ, Lee JK, Lee H et al. The therapeutic potential of human umbilical cord blood-derived mesenchymal stem cells in Alzheimer's disease. Neurosci Lett. 2010;481:30–35. doi:10.1016/j.neulet.2010.06.045. Epub 2010 Jun 19.
【9】Honmou O, Houkin K, Matsunaga T et al. Intravenous administration of auto serum-expanded autologous mesenchymal stem cells in stroke. Brain 2011;134:1790–1807. doi:10.1093/brain/awr063.
【10】Oh K-W, Moon C, Kim HY et al. Phase I trial of repeated intrathecal autologous bone marrow-derived mesenchymal stromal cells in amyotrophic lateral sclerosis. Stem Cells Transl Med 2015;4:590–597. doi:10.5966/sctm.2014-0212.
【11】 Mazzini L, Mareschi K, Ferrero I et al. Autologous mesenchymal stem cells: Clinical applications in amyotrophic lateral sclerosis. Neurol Res 2006;28:523–526. doi:10.1179/016164106X116791.
【12】Petrou P, Gothelf Y, Argov Z et al. Safety and clinical effects of mesenchymal stem cells secreting neurotrophic factor transplantation in patients with amyotrophic lateral sclerosis: Results of Phase 1/2 and 2a Clinical Trials. JAMA Neurol 2016;73:337–344. doi:10.1001/jamaneurol.2015.4321.






