自发现以来,基于CRISPR的基因编辑系统已经从根本上改变了研究者们操纵基因组的能力。近日,Cell杂志推出CRISPR特辑——Gene Editing in Stem Cells,用2个SnapShots、2篇综述以及7篇论文,回顾了近阶段基因编辑技术与干细胞之间“擦出的火花”。
Cell Stem Cell高级科学编辑Sheila Chari在前沿中写道:当与干细胞结合时,这些基因编辑工具有能力重塑我们对人类遗传学、发育生物学和再生医学的理解。基于CRISPR的平台已经被成功用于干细胞中,用以解决人类生物学的基本问题,并为疾病建模和药物发现提供了实验工具。此外,首个基于CRISPR的干细胞疗法已经进入临床测试。这一特辑集合了这一快速发展的领域的一些最新进展。具体如下:
两篇综述
1# Induced Pluripotent Stem Cells Meet Genome Editing
当诱导多能干细胞遇上基因组编辑
这篇由加州大学伯克利分校和MIT的两位科学家在Cell Stem Cell杂志上发表的综述文章回顾了人类诱导多功能干细胞(iPSCs)和CRISPR/Cas9技术的发展如何从根本上改变了研究者们对生物医学、干细胞生物学和人类遗传学的研究。此外,综述还讨论了iPSC和基因编辑技术存在的一些挑战,以及两种技术联合带来的道德辩论。
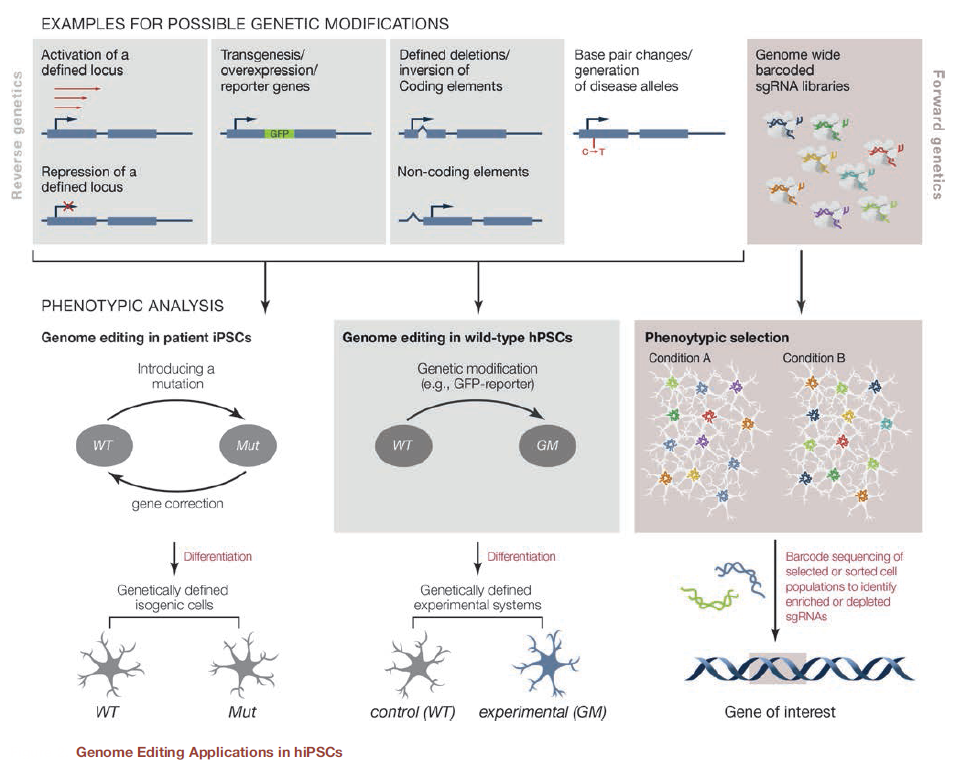
2# Applications of CRISPR Genome Engineering in Cell Biology
CRISPR基因组工程在细胞生物学中的应用
这篇于2016年9月发表在Trends in Cell Biology上的综述总结了CRISPR在细胞生物学研究中的多种应用,包括功能基因组学研究、转基因动物模型的构建以及用于活细胞和组织中的基因组成像和谱系追踪。作者们认为,新型基因组工程方法的发展为理解基因组与表型之间的因果关系提供了一条新的途径,因此,有望使科学家们对细胞生物学有更全面的了解。
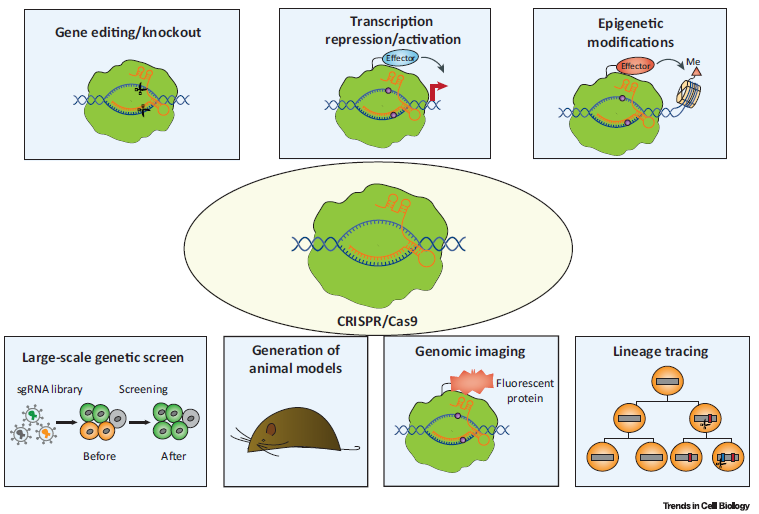
Applications of Clustered Regularly Interspaced Short Palindromic Repeats (CRISPR)/CRISPR-Associated Protein 9 (Cas9) to Cell Biology Research.
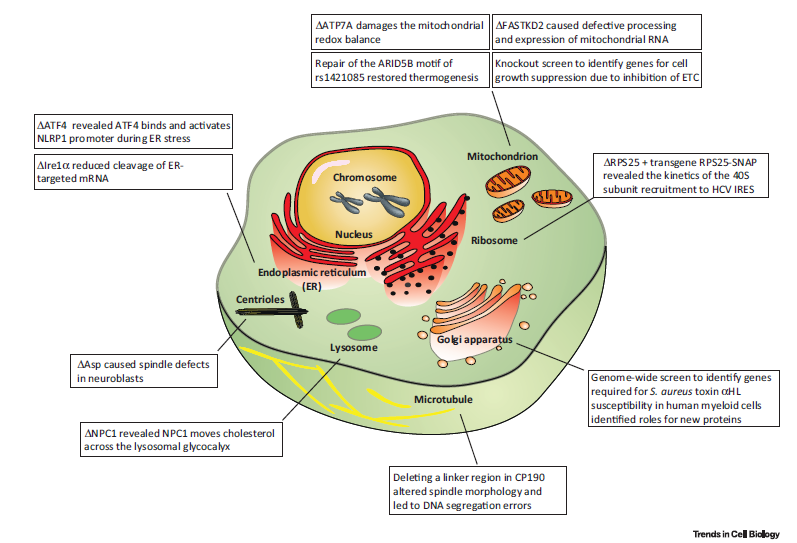
Examples of Applying Clustered Regularly Interspaced Short Palindromic Repeats (CRISPR)/CRISPR-Associated Protein 9 (Cas9)Technology to Study Cellular Organelles.
七篇论文
1# A Single CRISPR-Cas9 Deletion Strategy that Targets the Majority of DMD Patients Restores Dystrophin Function in hiPSC-Derived Muscle Cells
治疗杜氏肌营养不良症
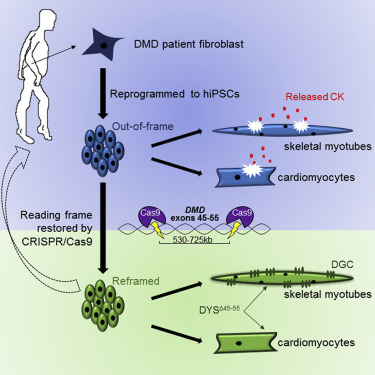
这篇于2016年2月在线发表于Cell Stem Cell的论文调查了用CRISPR技术来纠正导致杜氏肌营养不良症(Duchenne Muscular Dystrophy,DMD)的基因突变(这种突变阻止了dystrophin的翻译)。研究人员将CRISPR/Cas9平台应用到DMD衍生的hiPSCs(DMD-derived hiPSCs)上。结果发现,由CRISPR改造后的hiPSC克隆系(clonal lines)衍生出来的心肌细胞和骨骼肌肌小管(myotubes)修复了dystrophin蛋白的生产能力。该研究的共同通讯作者April Pyle说:“这项工作证明了一种可行性,即,利用简单的基因编辑平台联合干细胞的再生能力,可纠正60%DMD患者的基因突变,并修复他们dystrophin的生产。”
2# CRISPR Interference Efficiently Induces Specific and Reversible Gene Silencing in Human iPSCs
用CRISPRi有效诱导人类诱导多能干细胞中的基因沉默
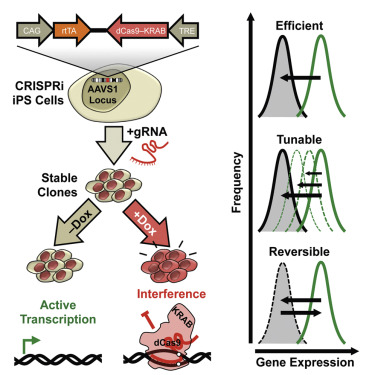
这篇论文中,科学家们开发了一种用于抑制人类诱导多能干细胞(iPSCs)中基因表达的CRISPRi(regularly interspaced short palindromic repeat interference)技术。具体来说,CRISPRi能够特异性地、可逆地抑制iPSCs以及iPSC衍生的心脏祖细胞、心肌细胞和T淋巴细胞中的基因表达。此外,这一基因抑制系统有可能使单个等位基因保持沉默。作者们认为,CRISPRi系统为在各种各样类型的iPSC衍生细胞中进行基因组规模的筛选,以及分析发育途径和疾病提供了强大的平台。
3# Targeted Epigenetic Remodeling of Endogenous Loci by CRISPR/Cas9-Based Transcriptional Activators Directly Converts Fibroblasts to Neuronal Cells
利用基因编辑技术直接“重编程”细胞的身份
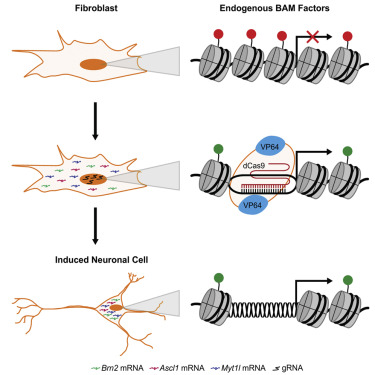
这篇论文描述了杜克大学的科学家们利用CRISPR/Cas9技术将从小鼠结缔组织中分离出的细胞直接转化成了神经元细胞。
2006年,日本京都大学的Shinya Yamanaka教授发现了如何让来自成人结缔组织的成纤维细胞返回到未成熟的、能够分化为任何一种细胞类型的干细胞状态,即诱导多能干细胞。仅仅六年后,Yamanaka教授就因此获得了诺贝尔奖。从那以后,研究人员也发现了变换细胞类型的一些其它方法。这些方法主要是通过引入许多“主开关基因”的额外拷贝。这些“主开关基因”表达的蛋白质能够启动与形成特定细胞类型密切相关的整个基因网络。
而在这项研究中,科学家们提出的转换细胞类型的策略不再需要引入额外的基因拷贝。他们是利用CRISPR的修改版直接启动已经存在于基因组中的天然拷贝。早期研究结果表明,这种方法产生的神经元细胞“身份”转变地更加完整和持久,可能能够用于神经疾病的建模,以及开发新疗法。
4# Interspecies Chimerism with Mammalian Pluripotent Stem Cells
干细胞里程碑!科学家首次培育出人猪嵌合体胚胎
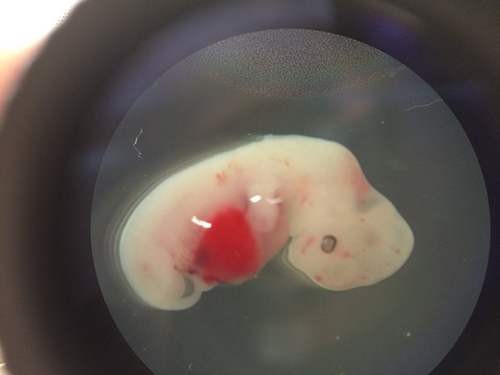
A 4-week-old pig embryo injected with human pluripotent stem cells
2017年1月26日,发表在Cell杂志上的这项研究中,来自Salk研究所的科学家小组借助CRISPR技术首次成功培育出了人-猪嵌合体胚胎。该研究的通讯作者 Juan Carlos Izpisua Belmonte表示,这是干细胞研究领域的一个里程碑。
具体来说,研究人员将人类诱导多能干细胞与猪的胚胎相结合,然后将这些嵌合体胚胎植入代孕母猪体内后,让这些胚胎发育仅3周或4周,以检查是否人类细胞发挥了作用。他们共将超过2000个人猪嵌合体胚胎植入到41只代孕母猪体内,一个月后,有186个胚胎存活。
值得一提的是,实验中,科学家们使用了3种不同状态的诱导多能干细胞。结果显示,中间态多能干细胞(intermediate hPSC)最适合形成嵌合体。该研究的第一作者Jun Wu称,不同状态的诱导多能干细胞在猪胚胎中形成“不等程度的嵌合”,但其总体比例较低。“我猜测每10万个猪细胞中可能只有不到1个人类细胞。”他说。【详细】
5# A G-Rich Motif in the lncRNA Braveheart Interacts with a Zinc-Finger Transcription Factor to Specify the Cardiovascular Lineage
解析lncRNA结构和功能
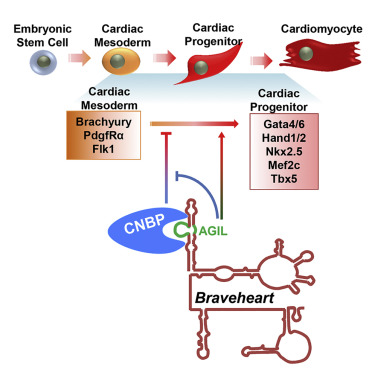
多年前,生物学家们发现了一种被称为长非编码RNA(long noncoding RNA,lncRNA)的新型遗传物质。这类RNA不编码蛋白质,是从基因组中曾经被认为是“垃圾DNA”的片段中复制过来的。之后,科学家们找到了lncRNA在许多细胞过程中起作用的证据,包括在胚胎发育过程中影响细胞的命运。但究竟lncRNA是如何发挥作用的还不得而知。在这项新研究中,利用CRISPR/Cas9编辑小鼠胚胎干细胞,MIT的生物学家们破译了一种类型的lncRNA的结构,并利用这些信息弄清了这类lncRNA如何与细胞内的蛋白质相互作用,从而控制心肌细胞的发展。相关成果于去年9月发表在Molecular Cell杂志上。
6# An Isogenic Human ESC Platform for Functional Evaluation of Genome-wide-Association-StudyIdentified Diabetes Genes and Drug Discovery
中美科学家合作完成糖尿病研究重要成果
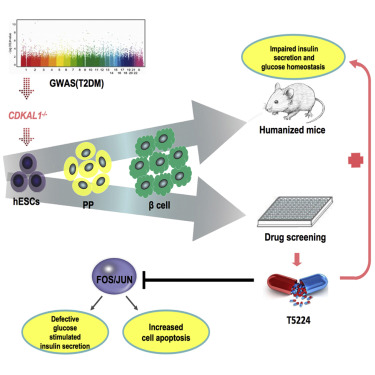
2016年8月,发表在Cell Stem Cell上这项研究中,美国康奈尔大学、中南大学湘雅医院等机构的科学家们利用人胚胎干细胞(hESCs)平台和高通量药物/小分子化合物平台,结合新型基因打靶技术CRISPR、新一代RNA测序技术以及hESCs定向胰岛beta细胞分化技术,在全球首次完成了2型糖尿病易感基因CDKAL1、KCNJ11和KCNQ1在hESCs向胰岛beta细胞分化过程中的相关功能验证,并阐述了这些基因在2型糖尿病发病中的部分机制,同时筛选出一种化学药物T5224(AP-1抑制剂)可以特异性修复CDKAL1基因缺失所导致的胰岛beta细胞功能损伤。
7# Stage-Specific Human Induced Pluripotent Stem Cells Map the Progression of Myeloid Transformation to Transplantable Leukemia
“精准复制”白血病进展
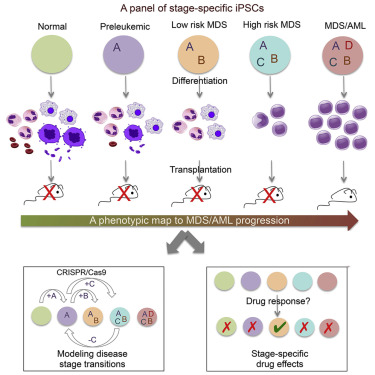
2017年2月,发表在Cell Stem Cell杂志上的这一研究中,来自西奈山伊坎医学院的研究人员创建了一种能够展示从正常血细胞到白血病一步步进展的新模型。研究中,科学家们利用CRISPR技术将来自骨髓增生异常综合征和急性髓系白血病患者的血细胞转变成了诱导多能干细胞。这类干细胞能够模拟疾病进展的所有阶段,从健康状态到“pre-malignancy”,最后到充分进展的白血病。这一研究标志着科学家们首次能够将白血病从人类“移植”到试管中,再到小鼠中开展研究。
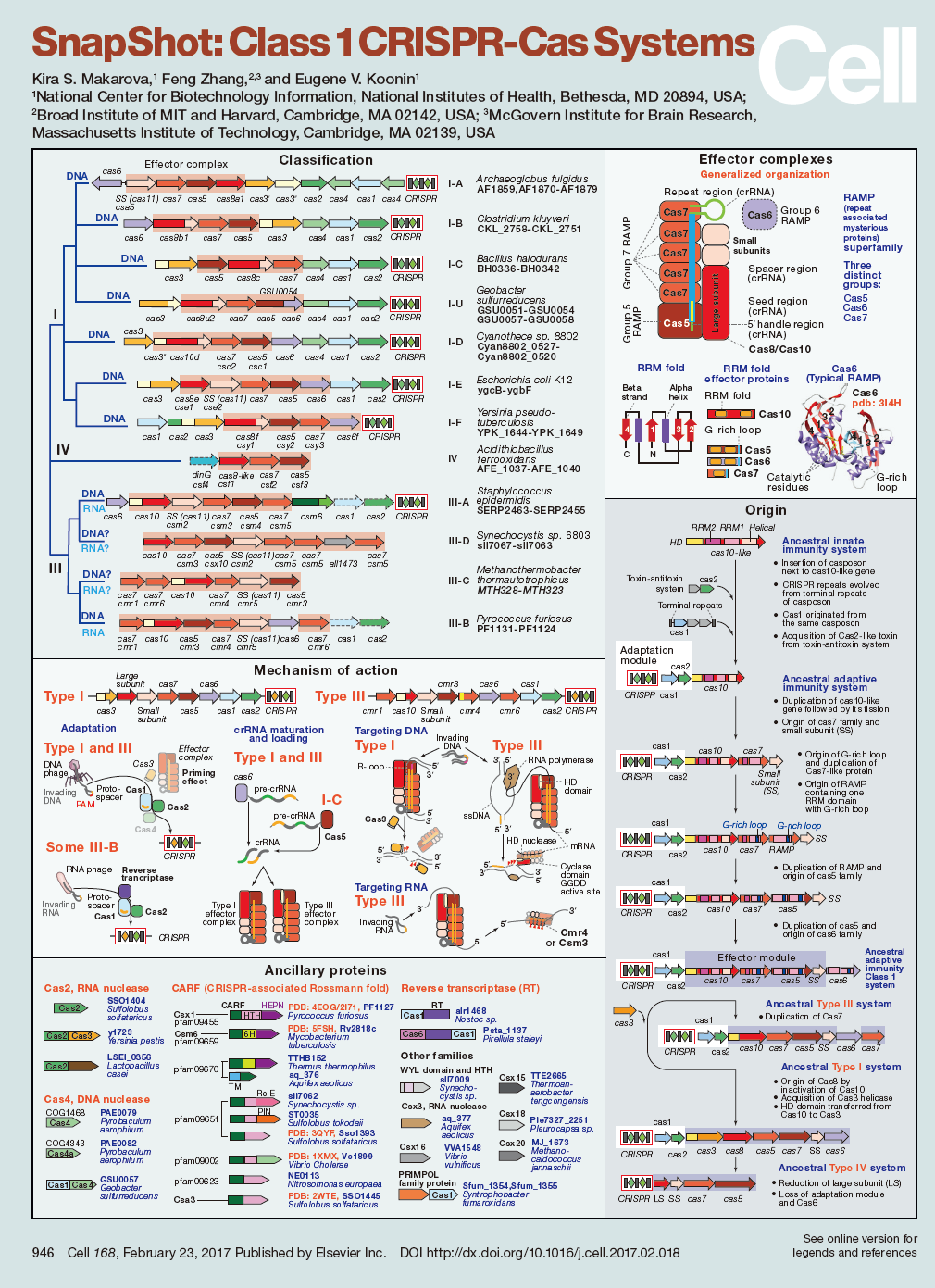
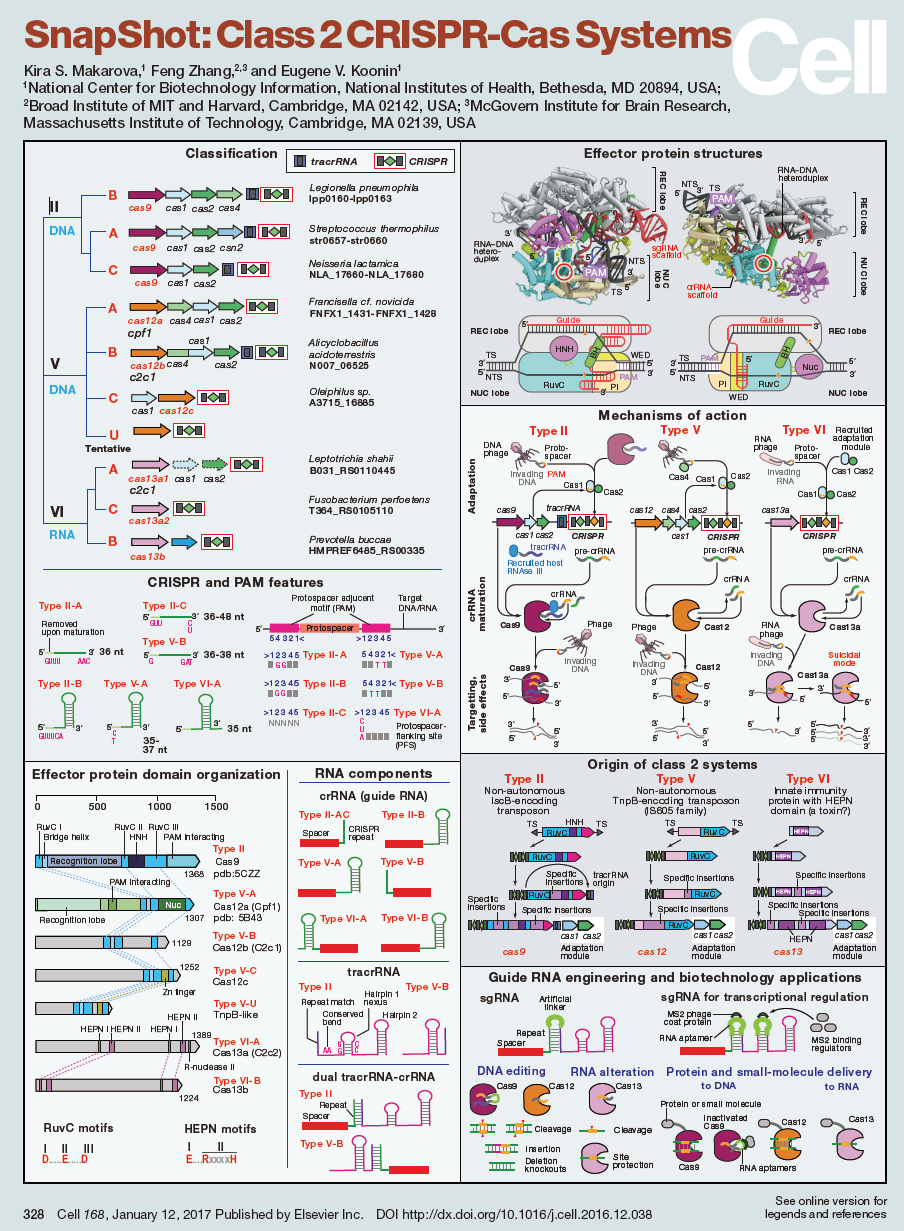
两个SnapShots:详解“魔剪”CRISPR家族
最后介绍一下这个特辑中包含的两个SnapShots。这两个由CRISPR先驱张锋以及NIH的两位科学家(Kira S. Makarova和Eugene V. Koonin)发表的SnapShot分别对1类和2类CRISPR-Cas系统进行了描述。
其中,2类CRISPR-Cas系统被分为3种类型、9个亚型。从概念上说,主要包括三个方面的应用:1)基因编辑,包括基因敲除、基因敲入以及引发突变;2)基因调控以及递送各种功能的部件(如转录因子)到DNA中特定的位置;3)靶向ssRNA。
1类CRISPR-Cas系统被分为3个类型(I、III、IV)、12个亚型。在功能方面,文章称,事实上,1类CRISPR-Cas系统中常见的多个Cas蛋白到目前为止还没有明确特定的功能。
小编曾在《张锋再发Cell:两张图详解“魔剪”CRISPR家族》一文中更加详细地介绍过这两个SnapShot的内容。感兴趣的小伙伴请点击【详细】阅读。
参考资料:
UCLA’s Stem Cell Gene Therapy Could Treat DMD Patients
Directly Reprogramming a Cell's Identity with Gene Editing
Linking RNA structure and function
中南大学湘雅医院与美国康奈尔大学联合公布2型糖尿病最新研究成果
Scientists create novel model that shows progression from normal blood cells to leukemia