人类与艾滋病已经斗争了超30年,从最初的绝症到现在的有效治疗,艾滋病正朝着慢性疾病的方向慢慢转变。但是,科学家们一直未曾放弃“治愈艾滋病”的梦想,他们正在努力研发能够治愈或者预防艾滋病的“良方”。
3月30日,Cell子刊《Molecular Therapy》在线发表了一篇题为“In Vivo Excision of HIV-1 Provirus by saCas9 and Multiplex Single-Guide RNAs in Animal Models”的文章,揭示了科学家们首次利用“魔剪”技术CRISPR有效剔除人源化小鼠多个器官中潜伏的人类艾滋病病毒。
“利用基因编辑治疗艾滋病”的研究思路从何而来?该技术如何应对HIV变异问题?它对于艾滋病治疗将会产生怎样的意义?带着这些疑问,生物探索有幸采访到这篇文章的最后通讯作者、美国天普大学医学院的华人科学家——胡文辉教授。他表示:“这种‘导弹式靶向剔除潜伏病毒’的尝试给以战胜艾滋病为终点的科学研究带来新的方向,它有望为彻底治愈艾滋病带来希望。”
“清除潜伏的HIV”——这是胡文辉教授自2008年在天普大学成立独立实验室以来一直试图克服的难关。他表示:“艾滋病难以治愈的根源正是潜伏于人体内细胞中的艾滋病病毒。”
根据世界卫生组织的统计数据,全球约有6000万人感染艾滋病毒,其中2000万人已死亡。近4000万感染者,75%集中在15个国家,而中国位列其中。人类免疫缺陷病毒(HIV)入侵人体,主要通过攻击T淋巴细胞瓦解免疫系统,致使患者免疫功能减弱,增加感染各种疾病或者发生恶性肿瘤的概率,进而威胁生命。
庆幸的是,随着核苷类逆转录酶抑制剂、蛋白酶抑制剂、抗逆转录病毒药物的相继问世,艾滋病不再是无药可治的绝症。“但是,转变成慢性病的艾滋病依然面临多种问题,包括药物副作用、神经损害、心血管损伤等等。”胡文辉教授强调,“在鸡尾酒疗法时代,仍有一半以上的艾滋病患者伴随有不同程度的神经认知功能障碍,而且轻型神经艾滋病(Neuro AIDS)患者数量正逐年增加。 ”
HIV作为逆转录病毒,变异性特别强。同时,它们通过将遗传物质永久性插入宿主细胞DNA中,形成病毒库。一般情况下,这些潜伏的病毒处于休眠状态,一旦脱离药物抑制,它们便会重新猖獗。所以,治愈艾滋病必须跨过“潜伏病毒”这一难关。
近年来,科学家们提出了多种针对潜伏病毒的方法,包括“先激活后绝杀”(Shock and kill)、敲除病毒(Knockout)、永久性潜伏(Permanent silencing)等等,他们希望通过实现从有效治疗到彻底治愈的转变,真正造福于患者。现在,胡文辉教授与同校同事Kamel Khalili教授、美国匹兹堡大学杨文彬教授课题组合作,第一次在动物模型上成功证实,利用基因编辑技术多靶点、高效剔除潜伏病毒的可行性。
当被问及“利用基因编辑治疗艾滋病”这一研究思路的由来,胡文辉教授表示:“利用基因编辑技术敲除HIV是解决潜伏病毒的一个重要思路。在我们试图应用传统基因打靶技术、ZFN和TALEN基因编辑技术尚未成功之际,张峰团队开发出可编辑人类基因组的CRISPR/Cas9系统,这给我们提供了一个很好的技术选择。”借助于引导RNA(gRNA)和Cas9核酸酶的完美配合,这一“魔剪”技术能够精准实现目标基因位点的切割、编辑工作。
2014年,胡文辉教授课题组和Kamel Khalili教授课题组合作,以实验室培养的潜伏有HIV病毒的人类细胞系为材料,首次成功利用CRISPR实现潜伏病毒的永久性清除,验证了最初的构想。这一利用基因编辑技术将艾滋病病毒从人类基因组中剔除的文章在《PNAS》期刊一经发表,就引起了业界的广泛关注。
随后2年多,他们从体外试验转向动物试验,不断优化这一有望彻底治愈艾滋病的治疗方案,并先后在《Scientific Report》、《AIDS》、《Gene Therapy》期刊发表研究成果。

这一篇最新发表在《Molecular Therapy》期刊的文章再一次揭示了有关靶向根治艾滋病的动物试验的可行性和有效性。
首先,胡文辉教授带领文章一作、博士后尹超然等课题组成员筛选和优化了多个靶向剪接的腺相关病毒(AAV)的基因疗法,在人类HIV转基因小鼠成功获得高效率剔除已经整合的HIV基因组(DNA),且能够显著抑制(高达60-95%)多个器官组织中HIV的基因表达(RNA 转录)。
随后,胡文辉教授课题组与杨文彬教授课题组合作,使用改建的鼠类HIV病毒(EcoHIV)建立艾滋病小鼠急性感染模型。因为人类HIV不能感染鼠类动物,他们将带有生物发光报告基因的EcoHIV病毒感染免疫缺陷裸鼠,同时给予HIV多靶点/saCas9的AAV-DJ8(人工合成的AAV血清型,综合了8种自然AAV的血清型特性),然后用活体动物生物发光图像检测仪(BLI)长时间(19天)监测动物全身的EcoHIV动态变化。他们首次证明多靶点基因编辑的AAV-DJ8基因疗法能够高效剔除鼠类HIV病毒(可达96%),并显著减轻HIV急性感染。
最后,他们在人源化小鼠HIV模型上证明多靶点/saCas9的 AAV-DJ8基因疗法能有效剔除多个器官组织中的人类HIV潜伏感染病毒。他们用人类HIV活病毒感染人源化BLT小鼠 (移植有人骨髓、肝和胸腺组织或细胞的免疫缺陷小鼠,其被艾滋病病毒感染和潜伏的方式与人类一致)建立HIV潜伏感染模型,给予HIV多靶点/saCas9的AAV-DJ8,2-4周后在多个器官组织中检测到HIV基因组的成功切除。
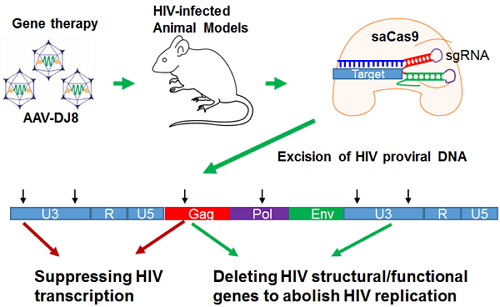
图示:腺相关病毒基因疗法将多靶点基因编辑“魔剪”导入HIV感染小鼠体内准确剔除HIV病毒基因组,进而抑制病毒转录和消除病毒复制。
为什么设计多个靶点?胡文辉教授表示有两个原因:第一,在HIV转录区和结构区设计了2-4个sgRNA实现多靶点切除,这有利于显著增加其剔除效率。第二,艾滋病病毒基因易于突变,应用单靶点基因编辑有可能会出现病毒逃逸现象。他认为:“多个有效靶点同时突变的可能性极小,即便某些个体患者出现突变,我们也可以快速重新设计和构建相关的Cas9基因编辑系统。这正是Cas9基因编辑用于精准医学的优势所在。”
针对CRISPR系统的脱靶问题,胡文辉教授告诉生物探索,他们早期发表的全基因组测序研究结果以及其它实验室的研究结果并没有发现脱靶效应。即使万一单个靶点存在脱靶的可能,但是两个或者多个脱靶点落在同一个正常功能性基因(仅占人类基因组的1.5%)的可能性微乎其微。
胡文辉教授强调,相比于目前的抗逆转录病毒药物,这一基于多靶点基因编辑的基因疗法最大的优势之一在于安全。团队精心筛选的靶点sgRNA都是针对外源性病毒基因的,它们对宿主靶细胞的基因组具有高度特异性,从而确保了在剔除病毒过程中不干扰宿主细胞的存活和功能。他觉得,这种“只杀病毒不杀细胞”的效果至关重要。
胡文辉教授表示:“目前,基因编辑疗法尚不能100%清除动物体内的艾滋病病毒,但能够显著降低潜伏病毒量。”谈及这一研究成果距离临床试验的时间,胡文辉教授坦言,尽管目前最看好的AAV基因疗法已经在世界各地进行临床试用,但用于艾滋病病人还有很多挑战和未知需要面对和解决:
第一,艾滋病治疗效果的评估。目前,科学家们只是在活体动物身上取得针对艾滋病的腺相关病毒基因疗法的高效病毒剔除结果,相关的治疗效果评估研究仍在进行之中,尤其是更接近于HIV病人的灵长类动物艾滋病模型,靶向剔除艾滋病病毒的可行性和有效性亟待测试。
第二,基因转移效率难题。在多细胞、组织和器官水平,治疗艾滋病和其它感染性疾病以及遗传性疾病和癌症的确切效果都取决于基因转移效率。
第三,潜伏的宿主细胞。目前,国际公认的HIV潜伏细胞包括T细胞、单核/巨噬细胞。而我们已有的腺相关病毒血清型是否足够转导所有的潜伏T细胞?另外,包括神经干细胞在内的其他细胞是否是尚未被发现的潜伏宿主细胞?
第四,CRISPR/Cas9技术自身的不断完善。Cas核酸酶的不断小型化和多元化?基因编辑的效率优化和特异性优化?
未来,能否找到靶向所有免疫细胞或者HIV潜伏细胞特异的基因疗法?是否可以借助纳米科技、类病毒颗粒优化CRISPR系统?采访最后,胡文辉教授畅谈了很多新想法。他说:“对于基因治疗艾滋病等疑难杂症的应用前景,我很有信心,也充满期待。下一步,我们将继续探索更有效、安全的基因疗法和细胞疗法。”

课题组合照
关于胡文辉教授
胡文辉博士毕业于中国协和医科大学基础医学研究所,是天普大学医学院(TUSM)代谢疾病研究中心和病理学系的终身副教授,同时也是四川大学华西医院的客座教授。他的研究工作获得多项美国国家卫生院(NIH)基金资助,其研究方向集中在艾滋病治愈、神经发育障碍、肥胖和胃肠道神经肌肉调节,先后发表学术文章70余篇,并拥有4项专利。