4月6日,Cell杂志发表了来自北京大学邓宏魁教授课题组题为“Derivation of Pluripotent Stem Cells with In Vivo Embryonic and Extraembryonic Potency”的最新重要研究成果,该研究系首次在国际上建立了具有全能性特征的多潜能干细胞系(EPS细胞),获得的细胞同时具有胚内和胚外组织发育潜能,并且该研究中还证明了人EPS细胞的异种嵌合能力,为未来利用异种嵌合技术制备人体组织和器官奠定了基础,为干细胞技术治疗重大疾病提供了新的可能。这是近年来在干细胞生物学或者说发育生物学领域的重要成果之一,这也标志着中国科学家在该领域的研究水平处于国际前列甚至是领先地位。

论文解读:
自1981年Martin J. Evans等首次建立起小鼠胚胎干细胞系以来,有关多能干细胞的研究迎来了一个黄金时期【1】,而1998年James A. Thomson实验室首次获得人胚胎干细胞之后【2】,围绕干细胞治疗相关的研究又迈上了新的台阶,此后的深入研究又可将多能干细胞(pluripotent stem cells,PSCs)分为 primed PSCs和naive PSCs(naive状态下的多能干细胞具有更好的发育潜能)【3】。
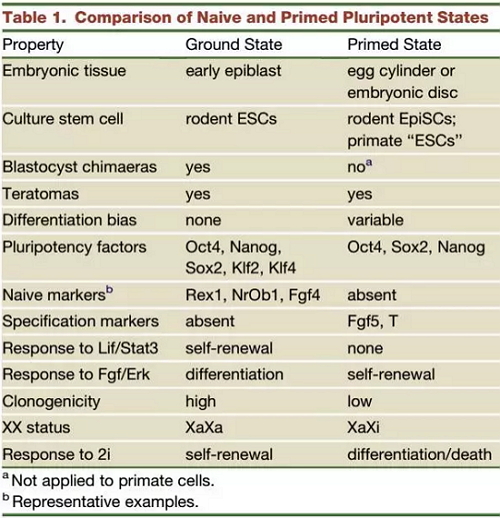
naive PSCs(ground state)和 primed PSCs之间的比较。引自:Nichols J, Smith A. Naive and primed pluripotent states. Cell stem cell, 2009, 4(6): 487-492.
多能干细胞(PSCs)顾名思义就是具有分化成多种细胞组织潜能的细胞,能够嵌合进入早期胚胎中并参与胚胎各个细胞谱系的发育,但是其发育潜能仅限于胚胎内的组织,很难发育为胎盘、卵黄囊等胚胎外的组织。如何在体外建立并维持具有胚内和胚外发育潜能的干细胞系,是当前干细胞研究领域最富挑战性的难题之一。尽管,此前有研究表明通过重编程的手段能够获得具有全能型特征的iPS细胞,但是这些细胞并不能形成很好的稳定的细胞系进行体外培养【4】。
邓宏魁教授研究组近几年来研究的一个重要方向就是运用小分子化合物诱导技术开发新的培养体系,建立不同类型的新型细胞系。其中最具代表性的成果就是2013年,Science杂志发表了邓宏魁教授和赵扬博士带领的研究团队用小分子化合物诱导体细胞重编程为多潜能干细胞【5】。
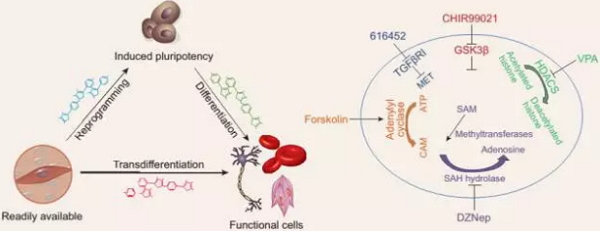
小分子化合物诱导的细胞重编程。图片引自:Li, X., Yang, Y., Yang, Z., & Deng, H. (2016). Chemical reprogramming: the CiPSCs and the CiNs. National Science Review.
在这项研究中,邓宏魁研究组通过化学小分子筛选,开发了一种全新的培养体系,能够建立具有胚内和胚外发育潜能的小鼠和人干细胞系。这一全新的干细胞被命名为潜能扩展的多能干细胞(Extended Pluripotent Stem Cells),简称为EPS细胞。
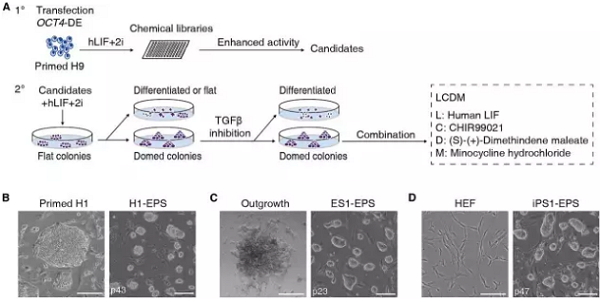
hEPS细胞系的建立
令人惊奇的是,单个小鼠EPS细胞即可高效地嵌合到小鼠不同发育时期的胚内和胚外组织中,并发育形成各种胚内和胚外的组织类型。通过四倍体囊胚补偿技术,进一步证明了单个小鼠EPS细胞能发育成为成体小鼠。该研究组还利用人鼠异种嵌合技术,分析了人EPS细胞的体内发育潜能。人EPS细胞注射到早期小鼠胚胎后,能够稳定地嵌合到小鼠胚内和胚外组织中,其胚内整合比例比已报道的整合效率提高了近20倍,并在mRNA和蛋白水平证明了人嵌合细胞能够向不同的细胞谱系分化。上述结果表明EPS细胞同时具有胚内和胚外的发育潜能。
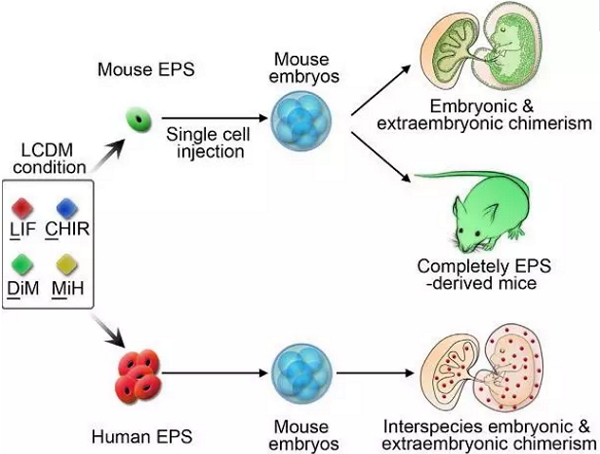
EPS细胞具有胚内和胚外的发育潜能
该项研究首次在体外建立了同时具有胚内和胚外发育潜能的干细胞系,即EPS细胞。EPS细胞为研究哺乳动物早期胚胎尤其是胚外组织发育的分子机制提供了新的工具。小鼠EPS细胞在单细胞水平所展现出的更强的嵌合能力和发育潜能,为建立小鼠遗传模型提供了新的手段。人EPS细胞的异种嵌合能力为未来利用异种嵌合技术制备人体组织和器官奠定了基础,为干细胞技术治疗重大疾病提供了新的可能。此外,采用同一培养条件即能建立人和小鼠EPS细胞,提示了EPS这一状态在哺乳动物不同物种中可能存在保守性,为未来在多个物种中广泛建立具有全能性特征的干细胞系提供了新的起点,对于干细胞研究具有重要的意义。
此外,Cell文章显示,该工作2016年12月20日投稿,2017年1月24日修回,然后2月1号接受,也就是说这篇论文从投稿到接受只用了40天左右的时间,这也从另一个角度显示这项工作的重要性以及受到杂志社重视的程度。
据悉,该研究由北京大学邓宏魁教授领衔完成,Salk生物医学研究所 Juan Carlos Izpisua Belmonte和北大人民医院生殖中心的沈浣教授为共同通讯作者,杨杨、刘蓓、徐君、王金琳、吴军为本文共同第一作者。
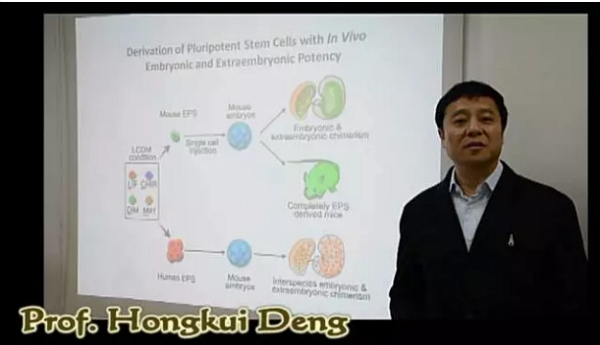
Cell论文在线版中所附相关视频截图,图为邓宏魁教授对该工作的简介
参考文献:
1、Evans, M. J., & Kaufman, M. H. (1981). Establishment in culture of pluripotential cells from mouse embryos. Nature, 292(5819), 154-156.
2、Thomson, J. A., Itskovitz-Eldor, J., Shapiro, S. S., Waknitz, M. A., Swiergiel, J. J., Marshall, V. S., & Jones, J. M. (1998). Embryonic stem cell lines derived from human blastocysts. science, 282(5391), 1145-1147.
3、Nichols, J., & Smith, A. (2009). Naive and primed pluripotent states. Cell stem cell, 4(6), 487-492.
4、Abad, M., Mosteiro, L., Pantoja, C., Canamero, M., Rayon, T., Ors, I., ... & Manzanares, M. (2013). Reprogramming in vivo produces teratomas and iPS cells with totipotency features. Nature, 502(7471), 340-345.
5、Hou, P., Li, Y., Zhang, X., Liu, C., Guan, J., Li, H., ... & Ge, J. (2013). Pluripotent stem cells induced from mouse somatic cells by small-molecule compounds. Science, 341(6146), 651-654.
注:本文部分内容引自清华-北大生命科学联合中心官网相关报道。






