造血干/祖细胞(Hematopoietic stem and progenitor cells,HSPCs)是一群能自我更新并分化为各种成熟血细胞的多能干细胞。基于其重建血液系统的能力,造血干细胞移植已成功用于治疗白血病等恶性血液疾病。如何体外诱导和扩增足够数量且有功能的HSPCs,是临床上恶性血液疾病治疗的瓶颈,也是基础科学研究的难点和热点之一。其目前尚未成功的根本原因在于人们对HSPCs产生和扩增的调控机制认识仍不全面。因此,应用模式动物深入和系统地研究体内HSPCs产生和扩增过程及其调控机制,将对体外诱导并扩增有功能的HSPCs具有十分重要的指导意义。
中国科学院动物研究所研究员刘峰领导的血液与心血管发育研究组早期的工作证实,参与5-羟色胺(5-HT)合成的转录因子Fev(哺乳动物的Pet1)是斑马鱼和人HSPCs发育所必需的关键因子(Blood, 2013);最近的合作研究发现FEV仅在出生前起源的白血病细胞表达,表明其可以作为白血病起源的诊断标记(Leukemia, 2016)。此外,有报道表明,5-HT处理体外培养的人脐带血HSPCs能促进其克隆形成能力,但机制不明。为深入探究5-HT与哺乳动物HSPCs发育的关系,刘峰研究组通过体外集落形成和脾结节实验发现,5-HT处理后的小鼠主动脉-性腺-中肾区(AGM)中HSPCs克隆形成能力显著增强。色氨酸羟化酶2(Tph2)是5-HT合成的限速酶。在其突变体胚胎中(tph2+/-和pet1-cre;tph2+/fl),AGM区造血簇大小和数目显著降低,HSPCs重建受体小鼠造血能力显著下降。为确定调控HSPCs的5-HT的来源,该研究发现Pet1、Tph2和AAAD等(参与5-HT合成的重要转录因子和合成酶)在AGM区内皮细胞和间充质细胞中均有表达。进一步研究表明,内皮细胞特异性缺失tph2(vec-cre;tph2+/fl)的小鼠胚胎中,5-HT在AGM区内皮细胞中会显著降低,HSPCs的发育受到影响。因此,AGM区内皮细胞产生的5-HT参与调控胚胎期HSPCs的发育。
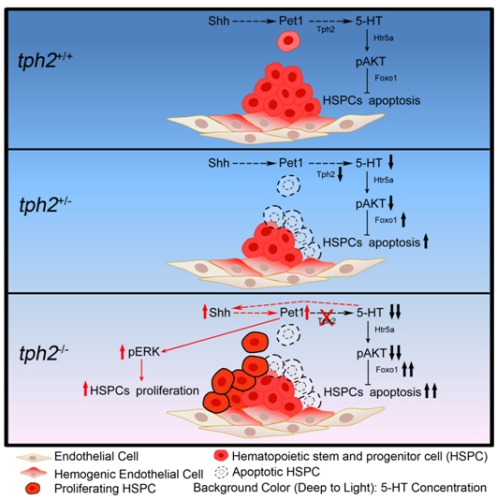
模式图:5-羟色胺调控小鼠胚胎期造血干细胞发育
RNA-seq及生化实验证实,AGM区5-HT的降低会激活AKT-Foxo1介导的促凋亡通路,致使小鼠胚胎造血簇中HSPCs凋亡显著增加。这一过程是由5-HT的受体Htr5a介导的。此外,研究过程中意外地发现,尽管在tph2-/-和pet1-cre;tph2fl/fl胚胎中,凋亡信号显著上调,但AGM区造血簇数量却是正常的。深入研究发现,在完全缺失tph2 的胚胎中,Shh-Nkx2.2-Lmx1b-Pet1通路因负反馈调控而上调,ERK信号被激活,导致造血簇中HSPCs增殖加快,进而使得tph2-/-胚胎中造血发育缺陷得到恢复。
上述工作首次证实了5-HT在胚胎期HSPCs发育和扩增中的直接作用。该研究不仅拓展和完善了体内HSPCs发育过程的调控机制,同时也为体外诱导和扩增有功能的HSPCs提供了新思路。该研究论文以5-hydroxytryptamine synthesized in the aorta-gonad-mesonephros regulates hematopoietic stem and progenitor cell survival 为题于12月28日在线发表于《实验医学杂志》(Journal Experimental Medicine,DOI: 10.1084/jem.20150906)。
研究组博士研究生吕军华和副研究员王璐为共同第一作者,刘峰为通讯作者,同济大学医学院教授丁玉强给予工具小鼠方面的大力支持。该课题得到了中科院干细胞与再生医学战略性先导科技专项、国家杰出青年科学基金、国家自然科学基金重点项目和国家重点基础研究发展计划的资助。