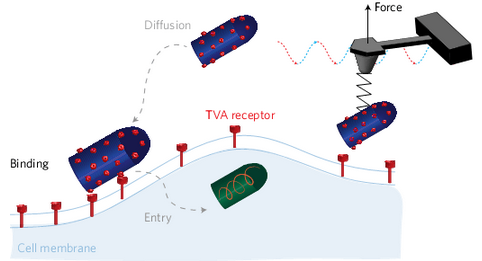
病毒的侵入以病毒与细胞表面受体结合为起点。但由于细胞膜的动态性与膜内外的异质性,目前还没有技术能够勾绘出病毒入侵宿主细胞的自由能全景图(free-energy landscape)。日前,瑞士苏黎世联邦理工学院(ETH Zürich)David Alsteens和Daniel Müller等科学家,通过对原子力显微镜与共聚焦显微镜进行改造,能够对表达有TVA受体的犬肾细胞进行成像,同时还能对狂犬病病毒与细胞间的结合过程进行定量分析。利用该技术,研究人员成功地勾绘出病毒与细胞结合的自由能全景图,并且阐明了病毒是如何通过一系列结合过程来入侵细胞的机理。该研究成果已发表于Nature Nanotechnology杂志上。

通常来说,病毒在进入细胞前,需要通过扩散作用与细胞接触。接触后,病毒通过包膜糖蛋白与细胞表面的受体进行特异性结合,同时激活包膜蛋白,利用膜融合的作用进入到细胞内。
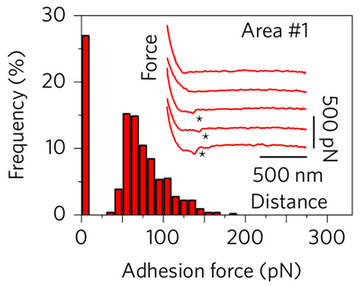
探针上的病毒与细胞之间的黏附力分布图。图片来源:Nature Nanotech.
接着,研究人员进一步从力-时间曲线中提取能量和动力学参数。他们发现,当将修饰以病毒的探针往回收时,图中出现了三处断裂,这表明病毒与细胞表面多个受体间存在着相互作用。
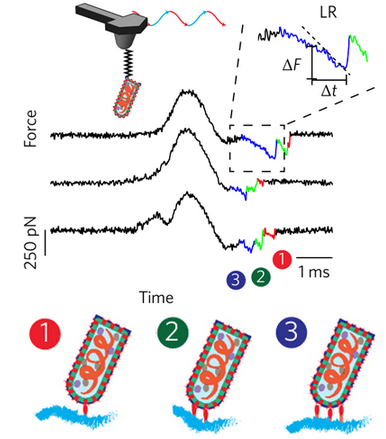
力-时间曲线及病毒与细胞表面的多重作用。图片来源:Nature Nanotech.
最后,研究人员通过分别研究单个断裂处的能量与动力学常数,绘制出了病毒与细胞结合的自由能全景图。他们发现,病毒的糖蛋白与细胞表面受体之间形成的第一个化学键有相对低的寿命与自由能,而之后形成其他化学键的寿命与自由能更高。由此,他们得出,病毒与细胞表面第一个受体结合力较低,但接下来与其他受体的作用会使这种结合力得到显著的增强,并且,两者之间形成的化学键也会因有利的变构作用得以迅速的加强。至此,研究人员详细阐明了病毒是如何通过一系列结合过程来入侵细胞的机理。
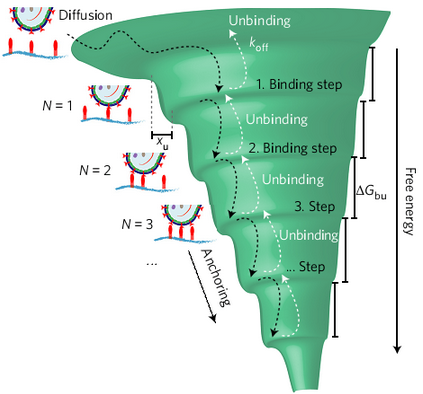
病毒与细胞结合的自由能全景图。图片来源:Nature Nanotech.
研究人员表示,该技术将有利于科学家进一步研究膜融合及内吞过程,来深入阐明病毒侵入的机理。此外,该研究不仅能揭示受体是如何被调节以利于病毒侵入的原理,还能够为药物分子干扰病毒侵入的研究,以及发展抗病毒的新药提供有效的工具。
参考资料:
Nanomechanical mapping of first binding steps of a virus to animal cells







