
不久前JUNO公司的CAR-T临床试验因神经毒性致患者死亡,失败原因众说纷纭。为此“易企说”在线沙龙邀请到科济生物医药(上海)有限公司董事长,同时也是上海交通大学医学院附属仁济医院上海市肿瘤研究所癌基因及相关基因国家重点实验室研究组长、博士生导师李宗海教授,和大家分享《“车”难开?细胞免疫治疗路在脚下》,一起聊聊CAR-T,具体剖析JUNO公司“车祸”的原因,探讨细胞免疫治疗未来的发展方向。
本文内容源自“易企说”在线沙龙《“车”难开?细胞免疫治疗路在脚下》,经李宗海教授授权,易贸医疗整理。
近年来,细胞免疫治疗越发引人关注,由于其能够弥补传统癌症治疗的弊端而被认为是肿瘤领域革命性的进展。不过,近期一连串的打击,给包括CAR-T在内的细胞免疫治疗发展前景蒙上了一层阴影。
➤➤ 细胞免疫治疗的“峥嵘岁月”

免疫细胞治疗的发展历程
自从斯蒂芬•罗森伯格教授1985年在《新英格兰医学杂志》上发表LAK细胞用于黑色素瘤治疗的案例开始,到2010年DC细胞应用在晚期前列腺癌病人的治疗中,细胞免疫治疗这些年的发展历程并不顺利。
“这是一个充满探索的过程,也是条布满荆棘的路”
今年7月JUNO公司CAR-T试验因神经毒性导致患者死亡,这并不是CAR-T疗法的第一次“车祸”。在2010年,罗森伯格教授针对Her2靶点的CAR-T疗法研究,在肠癌肺转移病人的实验中发生了致死事件。就在同一年他们还开展CAR-T针对CD19的工作,并公开发表。
不过令人鼓舞的是,在2011年Carl June团队利用CAR-T细胞治疗慢性淋巴细胞白血病患者,并达到了CR。到了2013年有一名急性淋巴白血病患者使用CAR-T疗法达到完全缓解。
CAR-T疗法一路走来,经历了很多曲折,最终能给病人带来希望,我觉得这是一个充满探索的过程,也是条布满荆棘的路。
➤➤ JUNO公司“车祸”剖析
细胞免疫治疗的发展历程遍布挫折,失败的“车祸”也有不少,最近大家比较关注的是JUNO公司CAR-T实验因神经毒性导致患者死亡的“车祸”事件。对于“车祸”原因,众说纷纭,有人说是靶点、信号,也有人说是细胞因子释放综合征,或者还有其他可能的未知原因等等。现在可以确定的是JUNO公司针对急性淋巴细胞白血病有JCAR015、JCAR014、JCAR017三个实验项目,此次事件中最初报道是JCAR015项目的3位患者死亡,后来又有JCAR014项目的1位患者死亡,共4位患者去世。

JUNO CAR-T“车祸”原因剖析
“CD19本身靶向的CAR-T是主犯,氟达拉滨和环磷酰胺是帮凶”
首先,已经有报道显示CD19在神经元有表达,但遗憾的是人们对于这方面的研究很少。不过需要注意的是,安进公司用于急性淋巴白血病治疗的Blinatumomab(CD19/CD13),发现有13%的严重神经毒性,而Blinatumomab并没有使用化疗药,因此化疗药并不是导致神经毒性的主要原因。
此外诺华研发的新药CTL019,实验中30个病人中有13个病人出现了神经毒性。根据他们的分析,神经毒性跟细胞因子释放综合征并没有直接相关性。同时他们用的是CD137信号,考虑到JCAR014用的也是CD137信号。所以不能认为CD28或CD137在导致神经毒性上有多大差别。综上可见,以上各公司的案例中,唯一的共同点就是CD19。
与此同时,其他TCR-T研究中,大部分没有出现神经毒性。在罗森伯格的研究中发现针对MAGE-A3的TCR-T会出现神经毒性,经过研究发现TCR-T可以同时识别 MAGE-12及其家族,而MAGE-12在神经元系统里是有表达的,也和靶点有关。所以我认为靶点是引起神经毒性的主要原因。
另外氟达拉滨也有促进作用,因为加入氟达拉滨,使得CAR-T在体内更好的扩充和存活,细胞数量增长,增加了杀伤毒性。因此JUNO公司的本次“车祸”,CD19本身靶向的CAR-T是主犯,氟达拉滨和环磷酰胺是帮凶。
“细胞剂量非常重要”

根据Clin Cancer Res的数据可见,细胞剂量非常重要
第二,细胞剂量也是很重要的原因,JACR014项目虽然没有公布具体剂量,但报道中说是高剂量组。这个项目并没有被停掉,只是控制剂量不再增加,这也就是我们常说的最大剂量毒性。
细胞免疫治疗的一个难点就是剂量,因为细胞免疫治疗的药是活的,和肿瘤细胞有一个数量比例,通常在体外实验时会考虑1:1,2:1或3:1。如果超过一定剂量,对正常细胞也会有毒性,超过一定比例毒性就会变得非常严重。因此要考虑药效,又要考虑毒性,比例的平衡要非常严谨。比如和相差只有1.4倍,但实验中,同样的药,第二组小鼠全部存活,第一组很快死亡,这说明量效关系非常敏感,需要在量效和毒性间找到一个平衡。

CAR-Her2致死案例
有这么一个案例,罗森伯格教授在做Her2的CAR-T之前,已经用其他免疫细胞治疗了142个病人,并没有出现致死事件。此外,考虑到Her2单抗新药和ADC药物都已经上市,多肽疫苗在临床中应用也是安全的,说明Her2靶点应该是比较安全的。过去他们在做TCR-T的时候,用量一般都在以上,平均在左右,因此给病人使用应该是可以的。但是当他有一次使用第三代的Her2-CAR-T时,注射后病人15分钟就出现了呼吸窘迫,使用呼吸机、激素都没有用,最后抢救无效死亡。后来在尸检中发现Her2在肺部表达,大量的CAR-T细胞浸润在肺部。
他们随后将这种情况第一时间向外公开,让别人得到足够的经验和教训,这是件非常伟大的事。罗森伯格教授在事后写了一段话,言辞里充满了困惑。他说,对晚期肿瘤病人,要开启一个新的临床研究,总有一种痛苦的纠结,你要给他足够的量,达到有效的剂量,但又要考虑安全性,这就是纠结。他建议还是要做严格的剂量爬坡,建议从比较低的剂量开始,这就是为什么需要这么多的尝试。
➤➤ 探索
“临床总是充满了不确定性,永远需要人探索”
还有一个案例,针对CD28的抗体药物,研究人员在临床前做了大动物(猴子)实验,因为人和猴子的CD28基本没太大差别,猴子也是抗体药物中常用的实验对象,所以他们认为这是很严格的模拟。但到了临床一期,六个志愿者全部出现细胞因子释放综合征,其中两人抢救无效死亡。所以临床总是充满了不确定性,永远需要人探索。
“对于肿瘤来说,最大的挑战是集团军作战“
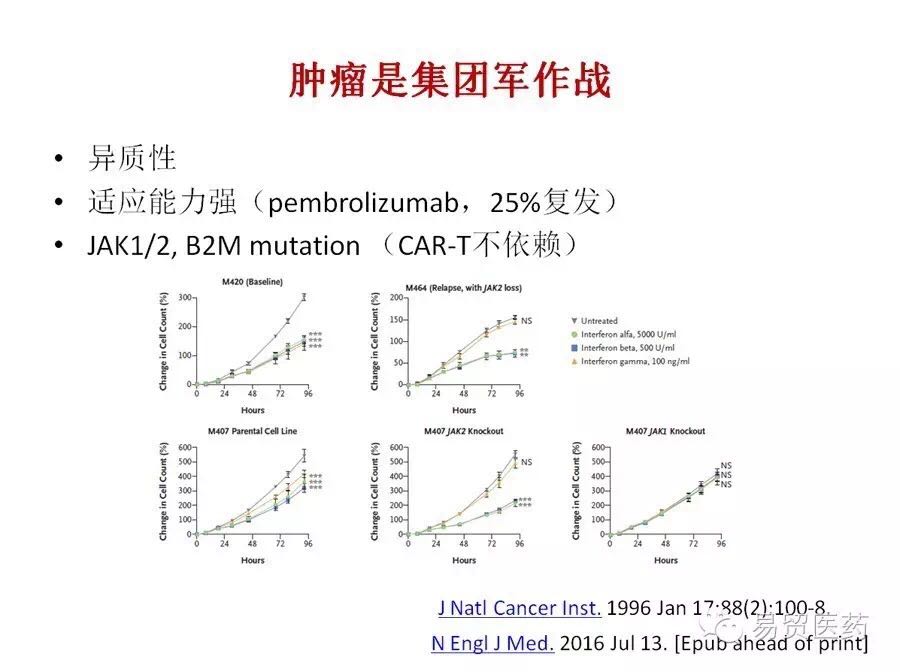
肿瘤是集团军作战
肿瘤长在不同的部位,同一部位不同的区域,基因突变谱都不一样,这样就有了更好的抗压能力。每一个都不一样,每一个都会伪装自己,最终形成集团军,有很强的适应能力,这样很可怕。
肿瘤也是非常狡猾的,7月13日在《新英格兰医学杂志》上报道的PD-1抗体耐药性研究很有启发意义,药物对病人很有效,但三年内有25%的病人复发。肿瘤是怎么逃避免疫抑制剂的?是通过自身基因的变化?还是本身群体里就有这些突变?
例如PD-1依赖MHCI递呈,而B2M是MHCI的组成分子,B2M突变,细胞膜表面MHCI下调,抗原就不能递呈,使得PD-1发生后的T细胞不能识别相应肿瘤。此外,Jak1/2的突变会导致干扰素受体的信号传递受到影响,这也成了PD-1抗体药物复发的另一重要原因。那么CAR-T出现这种情况该怎么办?CAR-T不依赖MHCI递呈,这是不是一种优势?会不会产生作用?这是我们正准备研究的,如果不探索,永远没有人知道。
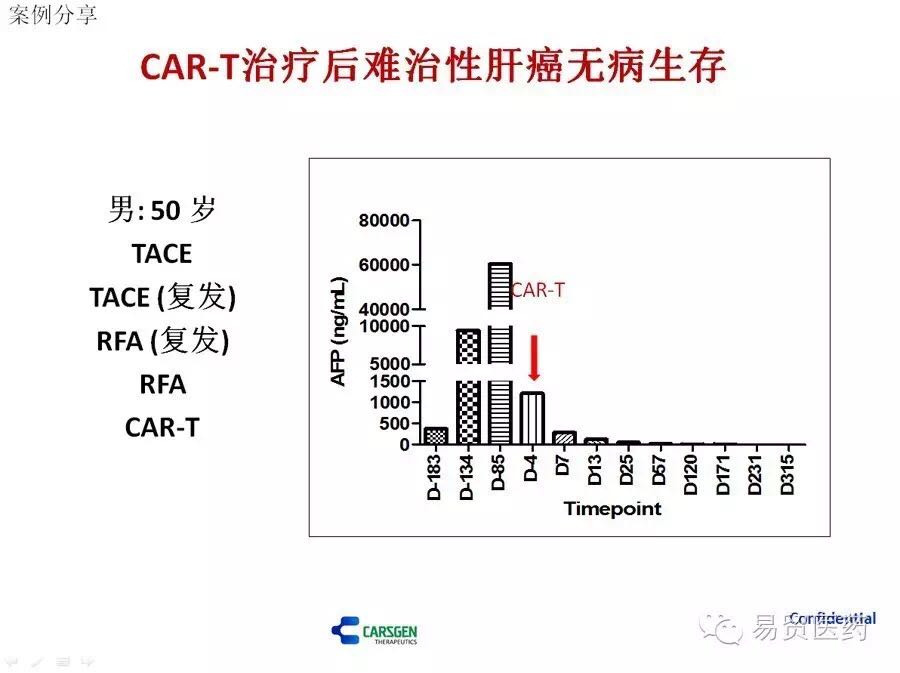
CAR-T治疗后无病生存案例
至于一些人说的带瘤生存,想法不错,但从经验来看,年轻的患者我希望能尽快清除干净,不把它清除干净,它总会想办法逃逸、扩张。有一个案例,该患者已经多次复发,肝癌标志物AFP维持着很高水平,但经过我们的CAR-T治疗后,AFP很快恢复正常,目前已经10个月无瘤生存,所有指标正常。病人身心达到比较好的状态,如果告诉他带瘤生存,估计他得吓的半死。
➤➤ 未来发展

细胞免疫治疗发展前景
细胞免疫治疗未来肯定是肿瘤治疗的终极办法,这是由肿瘤本身的特点决定的。如果把肿瘤比喻成黑社会,免疫细胞就是公检法,肿瘤是由自体细胞演化而来,是经过与免疫系统相互勾结、妥协后的组织,所以肿瘤治疗要改造免疫系统。我们需要大量的研究,包括对靶点的研究,对新一代CAR-T技术的研究,我提倡使用鸡尾酒疗法,当然这会更有挑战。因为肿瘤是自体细胞演化而来,和我们自身有非常紧密的关系,并善于伪装,所以需要更精准,否则杀敌的同时也会对自身造成巨大损失,这也需要更多的临床研究。
此外细胞免疫治疗不仅应用于肿瘤,还在免疫性疾病、传染性疾病、艾滋病等领域都有可能应用。将来的发展应该是全产业链的布局,提高药效、降低成本等都很重要。还有上下游产业的结合,包括自动化装置、培养基,现在很多都依赖于进口。
另外还希望社会有更多的包容,对晚期病人不去尝试肯定是没办法的。再就是监管,这几年监管部门一直在不断改革,提高效率。相信监管部门会尽快拿出更好的监管方案,来促进这件利国利民的事。
在随后的Q&A环节中,李宗海教授针对细胞免疫治疗如何发展,TCR-T技术,联合免疫疗法等热点问题回答了现场听众的疑问。
Q:有听众认为医学应该通过考虑先进技术来解决问题,但目前商业化过多考虑利益,所以这其实是有点矛盾的两方观点,对此您是怎么认为。
李宗海:我比较赞同他的观点,我今天刚在浙江大学做了一个《以病患需求为中心的创新与创业》为题的报告,我认为我们的宗旨是要治病救人,如果能治病救人,就不用担心回报,如果不能治病救人,那就根本不要谈什么市场。在这个阶段,尤其是中国很多东西还不是那么成熟的情况下,不要过多纠结太多市场回报。至少以我的观点来说,现阶段还是要以创造更好、更安全有效的技术来给病人带来帮助。如果达到这点,我相信肯定会得到很好的回保。
Q:所以您觉得应该首先考虑技术方面的问题,然后再来考虑另外一方面的问题?
李宗海:对,现在唯一做得比较好的是白血病,国际上已经做得较为成熟。其他像实体瘤和别的血液肿瘤,我觉得挑战还是很大。为什么我们要做找细胞免疫治疗?就是因为以往的治疗效果不是那么让人满意,所以大家要进行探索,甚至要冒一些风险。说实在的,要想赚钱,有很多可以赚钱的行业,为什么要做这么充满挑战,充满未知的事?是因为你觉得做这件事有两个很重要的特性。首先它是治病救人;第二市场很大,如果可以治病救人那么回报会很丰厚,但前提是建立在第一点,没有第一点就没有第二点。
Q:慢病毒和逆转录病毒在临床试验中都有应用,请问两者在转染效率、规模化生产成本等方面各有哪些优劣?
李宗海:目前大家主张用慢病毒,因为逆转录病毒出过事,曾经在儿童身上引发过重症免疫缺陷症。当时是法国的一个临川研究,为11名儿童做治疗,使得3位患者出现T细胞白血病,这是因为逆转录病毒正好整合了一个癌基因,导致白血病。
反观慢病毒已经做了几十上百起临床研究,甚至可能更多,也没有出现过类似的事件。另外从生产来说,慢病毒也更有优势,因为慢病毒更稳定,将来的储存更方便,所以我建议使用慢病毒,国外的趋势也是由逆转录病毒转向慢病毒。
Q:您如何评价Carl June团队准备开展的基于CRISPR的CAR-T治疗实体瘤的临床试验?这是否是CAR-T未来重要的趋势之一?
李宗海:CRISPR是一个非常好的技术,可以解决现在很多基因工程做不了的事,但不管怎么说,这个技术都是有待实验考证的。这是很好的研究方向,需要有人探索、创新,还是让时间来验证吧,因为我说什么都太早。
Q:对于突破国外公司的专利保护,您有什么建议?
李宗海:我的建议很简单,就是自己创造更好的技术。所以我们团队一直致力于研发新的技术,现在已经有二十多个专利,预计今年还有很多要申请。当然还有一个办法是花钱买。
Q:对于腺癌、鳞癌细胞,如果不通过手术,会有哪些比较好的办法来控制?
李宗海:如果是不能手术的晚期患者,腺癌的治疗手段很多,包括化疗、小分子药物等等。鳞癌就比较麻烦,并没有太多新的药物。如今PD-1抗体是腺癌、鳞癌都可以用。如果是CAR-T的话,我们(指科济生物——编者注)就做的很好,除了我们外,韩卫东教授也有做的比较好的CAR-T项目。
Q:能不能科普一下TCR-T的难点和可以解决的方案?
李宗海:TCR-T我们没有做特别多的尝试,在我看来TCR-T存在几个问题。
第一、改造以后,往往特异性没有那么好了。比如之前提到的MAGE-A3抗原,TCR-T可以同时识别MAGE-12导致神经毒性,类似的案例还有很多,还有病人致死的事件,所以TCR-T不是那么容易做的,也是非常有挑战的。
第二、T细胞的本身就有内源的TCR的基因,转染的TCR就会跟它有一个错配重组,也就带来一个新问题。
第三、TCR-T用量会比较大,罗森伯格他们的使用量达到了5×10的10次方,这么大的细胞剂量,培养时间会很长,成本也会增加。
第四、TCR-T也会依赖于MHC-I的抗原提呈,如果MHC-I表达受影响,TCR-T应该也会受影响。
但我个人觉得TCR-T还是有自己独到的优点,可能也会有很好的发展。
Q:目前在中国号称做细胞免疫治疗的公司有很多,技术也是参差不齐,对于这样一个市场情况,您是怎么看待的呢?
李宗海:首先我觉得这不是市场情况,现在还没达到市场的阶段,现在只是在研究阶段。现在是百花齐放、百家争鸣,只要按规则玩,我个人认为这是个好事。但在知识产权这方面还要是有自己的创造,还是需要有新的技术来推动行业发展。
Q:最近看到日本一家公司公布了PD-1抗体药物和细胞免疫治疗联用的不良影响,出现了一些严重副作用和死亡事件,这跟我们鼓励联合疗法有比较大的出入,大家都感觉比较意外,您对这个事件如何看?也谈谈对联合疗法有什么想法?
李宗海:我看过这个新闻,但对他采用哪种细胞免疫治疗并不清楚,对他怎么用药也不太了解,这个问题我需要对每个数据进行分析,没有看到数据,很难评判。我个人认为联合疗法是一种趋势,肿瘤的变化能力太强了,单靠一种手段想斩草除根是蛮难的。至于怎么控制毒性,是大家要考虑的问题。
Q:最近看到某家咨询公司公布了一些数据,2020年CAR-T和TCR-T肿瘤细胞免疫治疗市场规模能达到1350亿元,您认为这是一个比较合理的预期吗?
李宗海:2020很年近了,我个人没那么乐观。如果是指全球是有可能的,如果说只是中国,我觉得达不到。因为只有细胞免疫治疗,如果是现在开始做临床研究,2020年能上市就不错了。
Q:近几年国内外合作比较多,比如药明生物和JUNO在上海成立的上海药明巨诺这家公司,您是如何看待这种跨国合作呢?
李宗海:这很正常,国际上这样的案例很多,一块蛋糕大家一起吃,能吃得好,关键是得有这块蛋糕,合作共赢肯定是未来的大趋势。将来我们到美国也有可能找当地的公司合作,这是很正常的。
Q:腺病毒做CAR-T的载体,您有什么想法?
李宗海:我觉得不大好,因为腺病毒的表达相对比较短暂,腺病毒不能整合到基因组,这是腺病毒的问题。但也不是说绝对不行,如果需要短暂表达,三五天就可以把肿瘤清干净,这是可能的,但要看具体怎么用,技术发展到什么阶段,我们不能轻易否认一件事。
Q:CAR-T胞内结构,在专利方面有没有限制?
李宗海:肯定有。不过有些专利已经过期,这需要自己做调研,所以首先要做一个知识产权尽职调查。
Q:通用型的CAR-T潜力有多大?您的团队有没有做这方面的研发?您认为CAR-T应该按照药物发展还是临床技术发展?通用型CAR-T成为药物的潜力有多大?
李宗海:通用型CAR-T是大家非常关注的,也不仅仅是商业的问题,对病人来说也更方便。你很难让每个病人都来抽血等两周,如果可以做通用型当然最好。异体CAR-T往往会产生两败俱伤或者互相残杀,外面T细胞要杀里面T细胞,里面要杀外面,因为大家都是免疫细胞,所以改造起来特别复杂,把体内的淋巴细胞都清干净,然后改造外面的T细胞再送回去。这样有比较大的挑战,把体内的免疫细胞清干净了,有没有想过将来做抗原交叉递呈?所以要有一些深层次的想法,不要人云亦云,是否还有其他的办法解决呢?可能要想更多新的方案。当然高手太多,中国十几亿人,什么奇人都有,相信会有更好的办法出来,将来值得考虑,现在也可以尝试了。
Q:关于靶点方面,现在的靶点是CD19为主,您从事的实体瘤方面有更好的靶点选择吗?
李宗海:我们现在做得很好有GPC3,这些信息都是公开的,也有人在做技术跟随。
Q:关于细胞免疫产业跟资本的合作,比如说安科生物和博生吉公司的合作,比如之前科济生物获得的B轮融资,算是很成功的案例,想了解一下作为技术方如何吸引资本介入?
李宗海:我们的B轮投资人是浙江佐力药业,还有韩国的KTB,浙江的凯泰资本,上海嘉稹投资,共有四家投资人。至于怎么找的,其实资本都在找项目,在当今中国不是缺钱的时代,是缺好项目的时代。其实不光中国如此,全世界都是这样,钱很多。你看帕克(指Sean Parker,Facebook早期投资者与前主席——编者注)一掏就是2.5亿美金出来做慈善公益抗癌研究。因为帕克的爱人就是乳腺癌去世的。
所以这年头不缺钱,缺得是好项目。我们上一轮没有自己出去找,投资方可能对我们比较关注,我们又刚好在这方面做了那么点工作,尤其是肝癌方面。所以大家还是比较尊重创新的,我觉得这是现在的一个趋势,中国人越来越重视创新,社会环境也越来越重视创新,制度也在不断改革,我觉得这是好事,希望步伐更快更大一点。
Q:您也提到,中国的细胞免疫治疗跟国外对比,某些方面已经领先于全球,但整体来说还是落后于国外,您觉得差距在哪里?我们应该如何追赶?
李宗海:首先我们在技术领域还是比较弱的,我们也有一些比较大胆的探索和尝试,像国内韩卫东教授等人也在做一些尝试。相对于其他药物和其他领域来说,这是一个差距相对没有那么大的领域,因为这一块中国一直都在做。但技术储备还是比较少的,体系都是人家搞得。
至于弥补差距还是要在技术上加大投入,扎扎实实搞原创性的技术。在靶点等方面,在新的联用策略方面等等,做一些更扎实的工作,不断向前推进,这不是一朝一夕之功。刚刚我已经说了,我读小学的时候,人家已经在做很多研究了,到现在过去了三十几年。我相信现在对肿瘤的认知,是三十年前完全不能比的。
现在经很多路已经走出来了,已经证明免疫治疗是可行的,大量的资金和人才都涌进来了。这是由肿瘤的本身决定的,有这么多人做事,经过这么多人的努力,肯定会找到解决肿瘤的办法,中国有这么多的人才,肯定可以做好。







