tRNA长久以来一直被认为是基因表达过程中的被动执行者,不具备表达调控的功能,更不曾与癌症的发生联系起来。另一方面,同义突变(synonymous mutation)本身并不会导致翻译产物——蛋白质的序列改变,因此也很少在癌症研究中受到关注。
不过,一项最新发表于Cell的研究极大地挑战了这两种观念。来自美国洛克菲勒大学的研究者发现,特定类型tRNA水平的波动会改变一个细胞的命运(包括癌变),甚至引起乳腺癌的发生,而相关的同义突变会直接决定该tRNA能够产生多大的影响。
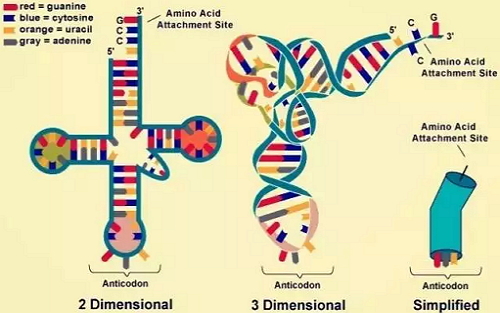
当细胞决定表达某个基因时,其DNA片段会转录出mRNA,后者主要由特定的三核苷酸单位——密码子(codon)组成。每个密码子(除了终止密码子)都会被一种专门类型tRNA上的反义密码子识别,而该tRNA只会携带一种氨基酸。当这些密码子被其对应的tRNA识别后,该tRNA所对应特定氨基酸即被引入,并在核糖体的帮助下被合成进入新生的多肽链。
由A、C、U、G四种核苷酸组成的密码子一共有64种,而细胞合成蛋白质所需的天然氨基酸只有21种。因此,有时不同的密码子会编码同一种氨基酸。比如,密码子GAA和GAG都只会编码谷氨酸(Glu)。如果基因发生GAA到GAG的点突变,就不会改变翻译产物的组成,这时就发生了同义突变。不同物种、组织对于各种密码子具有不同的偏好性,比如A物种或组织习惯使用GAA编码谷氨酸,而B倾向于采用GAG。
然而,就是这些在基因表达中看似“默默无闻”的组分其实与癌症的发生有关。
研究者采用了最新的基因组测序技术对细胞中不同种类tRNA的含量进行了测定。在对正常乳腺组织、良性乳腺肿瘤和已扩散的恶性乳腺肿瘤进行分析后,他们发现恶性肿瘤细胞中的两种tRNA水平要明显高于正常组织和良性肿瘤。
“一共有四种不同的密码子可编码精氨酸(Arg),”文章的作者Sohail Tavazoie博士说道:“但是只有CGG这一种密码子对应的tRNA(即tRNAArgCCG,其中CCG是CGG的反义密码子)与肿瘤细胞的扩散有关。”这其中另一种高表达于恶性肿瘤的tRNA是识别密码子GAA并将其翻译为谷氨酸的tRNAGluUUC。
为验证这两种特定的tRNA是否可直接导致癌症发生,研究者上调了良性肿瘤小鼠模型中的上述tRNA表达量,发现在这之后癌细胞的扩散性果然明显上升。毫无意外的是,当他们调低了两种tRNA水平后,扩散癌细胞的数量出现了下降。
人们不禁要问,这些tRNA是如何导致肿瘤扩散的呢?这时,蛋白质组学的分析给出了答案。
“我们发现很多基因的表达水平出现了上调,” Tavazoie博士说道:“在大多数这些被上调的基因中,上述两种密码子的含量明显偏高。”
在这当中,tRNAGluUUC被发现可极大地提高EXOSC2和GRIPAP1这两种基因的表达水平,二者均被认为与癌症发生有关。tRNAGluUUC上的反义密码子序列UUC可专门识别表达谷氨酸的密码子GAA,后者在两种基因中含量偏高。
“我们把两种基因中的GAA密码子序列突变为GAG——这是一个并不会改变谷氨酸作为翻译产物的同义突变。这样之后,我们发现它们的表达水平就不会随着上述两种tRNA的上调而应声提高了。”
显然,特定tRNA水平的上调会提高含有其对应密码子的mRNA被翻译的几率,而这些表达量因此明显上升的蛋白质就好比它们的“下游信号”。这样,细胞的蛋白表达谱会发生整体性的改变,影响细胞在接下来的命运,包括癌变。tRNA可能就是细胞基因表达调控机制中的一部分,有着被开发为治疗靶点的潜质。
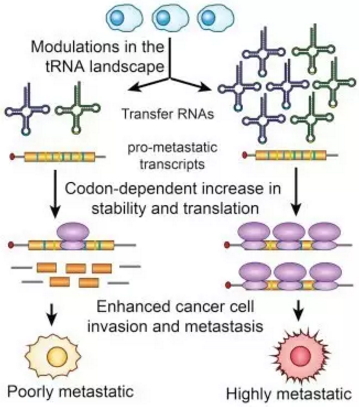
tRNA影响癌症发生的机制
“这是一个很值得注意的结果:在某一类型的细胞中,同义突变可以显著地改变特定蛋白的表达量和细胞的整体行为模式。”







