
自2015年7月“史上最严药物临床试验数据自查令”下达以来,许多制药企业陷入集体慌乱状态,“撤回申请”如潮水般席卷全国药企。
2016年1月14日,在北京召开的全国食药监暨党风廉政建设工作会议上,CFDA局长毕井泉表示,截至2016年1月12日,在原先1622个药物注册申请中,撤回和不通过合计1151个,占自查核查总数的80%,其中企业主动撤回占到77%,剩余待核查项目273个。
“CFDA去年使出重拳、肃清治理临床数据造假行为,导致46.3%的药品注册申请不被受理,直接导致了数百家医药企业近30亿元的研发资金‘打水漂。”业界对此表示道。
在严查背景下,“撤回申请”显然还在持续
据据投壶网(微信:touwho2015)查证,3月,CFDA发布公告显示,2016年1月21日至2月23日,收到11家企业提出的撤回列入2015年7月22日《关于开展药物临床试验数据自查核查的公告》(国家食品药品监督管理总局公告2015年第117号)的21个药品注册申请。其中,大部分为北京的机构,达到13个。
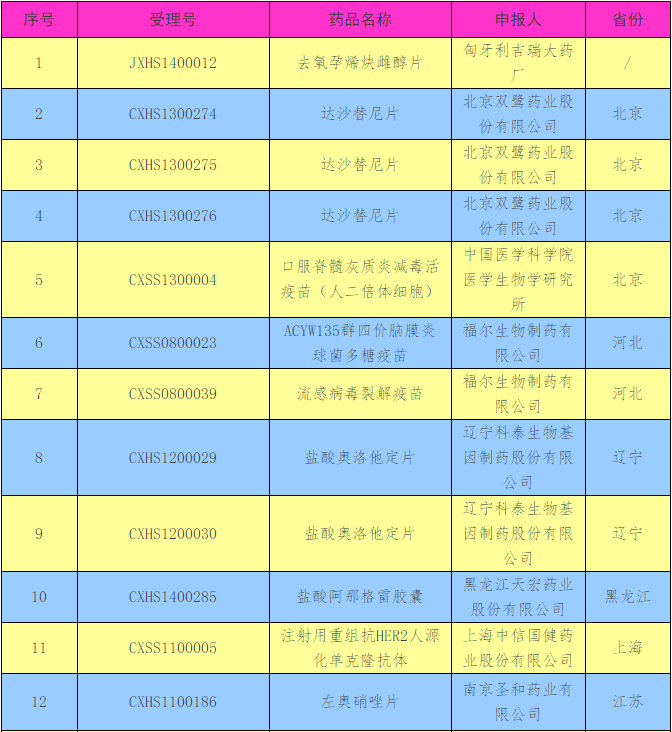
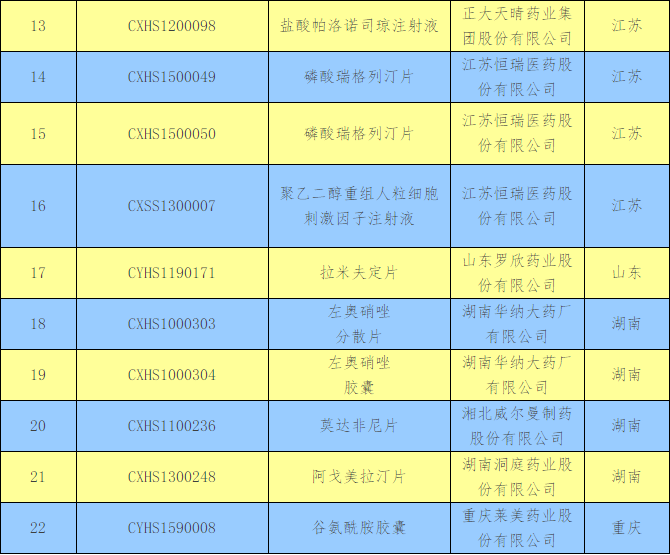
时隔2个月,近日,CFDA再发公告,15家药企将撤回22个药品注册申请,其中江苏“拔得头筹”,占据5个;北京、湖南达到4个;河北、辽宁2个、黑龙江、上海、山东、重庆分别有1个。
尽管属主动撤回,但在相关专家看来,这无疑会对相关企业产生重大影响。“药物临床研究是医学科学家的科研行为,具有较高风险,且会占用医疗资源。同时,对于那些已经组建专业团队负责公司已在相关地区上市的产品而言,撤回会延后相关品种的国内上市时间,必定会对企业经营业绩产生影响。”
撤回药品注册申请清单
登入投壶网官网成为注册投资人,或关注微信公众平台(微信:touwho2015),可免费领取价值5200元的(第十八届)中国风险投资论坛门票一张。







