
同许多其他类型的肿瘤一样,乳腺癌肿瘤同样具有高度异质性。不过,所有的乳腺癌肿瘤都有一个共同的来源,那就是乳腺癌干细胞。同其他肿瘤干细胞一样,乳腺癌干细胞不仅会产生癌细胞,还与癌细胞对化疗和放疗发展出抗性的过程有关。因此,如果能找到一种阻止乳腺癌干细胞产生癌细胞的方法,那么就有望用于所有乳腺癌患者的治疗。
来自美国奥古斯塔大学(Augusta University)的科学家最近就找到了这样的一种方法,它利用了两种已被投入使用的化疗药物——五氮杂胞苷(5-azacytidine)和丁酸盐(butyrate)。研究表明,两者共同使用时可显著减少乳腺癌干细胞的数量,并提高乳腺癌模型小鼠的存活率,而其中任一种在单独使用时均起不到上述明显的效果。同时,在人类乳腺癌细胞系的试验中,这一抑癌效果也得到了验证。难能可贵的是,目前大多数的化疗手段均不能作用于产生肿瘤的源头——肿瘤干细胞。
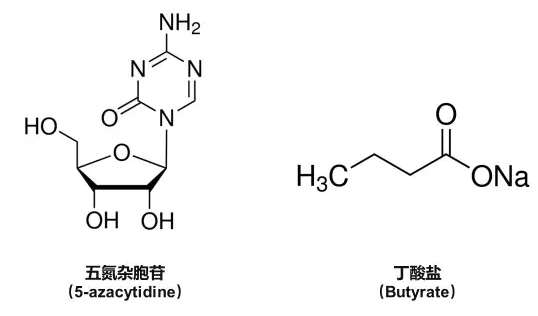
事实上,这两种药物现有的用途在于通过联合作用以提高另一种抗癌药他莫昔芬(tamoxifen)的效果,用于治疗雌激素受体阳性(estrogen-receptor-positive)乳腺癌。这种亚型约占所有乳腺癌病例总数的70%。他莫昔芬作为雌二醇竞争性拮抗剂,能与乳腺细胞的雌激素受体结合,从而抑制依赖雌激素生长的肿瘤细胞。这时,如果能同时加入使用五氮杂胞苷和丁酸盐这两种药物,患者的肿瘤复发率就会显著降低。
而这一最近发表在《Cancer Research》期刊上的研究则揭示了其背后的根本原因——这两种化疗药物通过改变部分与细胞生长相关基因的表达,作用于至少两种乳腺癌干细胞产生癌细胞的关键过程。这两种过程均涉及到了表观遗传调控机制中的重要酶,包括DNA甲基化转移酶1(DNMT1)和去乙酰化酶(HDAC)。
其中,五氮杂胞苷是DNMT1的抑制剂,而DNMT1对于维持健康乳腺细胞和肿瘤干细胞的功能都至关重要。不过,DNMT1在乳腺癌细胞中的表达量要比健康组织高得多,而过高水平的DNMT1将会抑制ISL1基因的表达。ISL1基因能够起到抑制肿瘤的作用,并可控制肿瘤干细胞的行为。因此,使用五氮杂胞苷将可在某种程度上恢复ISL1基因的表达,以起到其抑癌效果。
另一方面,丁酸盐是HDAC的抑制剂,能够有效抑制RAD51AP1和SPC25两种信号分子的表达。这两种蛋白本是用来修复可引起致癌突变的DNA损伤的。然而,一旦癌变已经发生,这两者便会加速癌细胞的生长和转移,而丁酸盐在这里便可有效抑制这一过程。
此外,这项研究还进一步支持了肿瘤干细胞作为癌症治疗靶点的潜在价值。这些干细胞原本可以产生乳腺中的健康组织。然而,在衰老和致癌物等内外因素的影响下,这些干细胞经历了表观遗传修饰,使得基因表达谱发生改变,便开始产生癌细胞以及肌上皮细胞等异常细胞类型。值得注意的是,在已经癌变的状态下,这样的肌上皮细胞可导致乳腺癌细胞在全身扩散。
有趣的事,既然肿瘤干细胞可以由于表观遗传修饰而产生,我们也就可能类似地通过表观遗传学的手段将其“调回去”,而这就是五氮杂胞苷和丁酸两种表观遗传调节剂的价值所在。
参考资料:
[1] Two known chemotherapy agents effectively target breast cancer stem cells
[2] Combined inhibition of DNMT and HDAC blocks the tumorigenicity of cancer stem-like cells and attenua






