在基础生物化学的课本上,关于真核生物翻译起始时都有介绍:所有的细胞信使RNA(mRNA)在它们的5'端都有一个7-甲基鸟苷(m7GpppG)的帽结构,从而促进高效的翻译和mRNA的稳定性。这个帽结构由翻译起始因子eIF4F识别。eIF4F 在mRNA的帽结构附近募集40S核糖体小亚基,然后朝着随后用于蛋白质合成的起始密码子附近扫描5'非翻译区(UTR)。
然而研究发现在有压力或在病毒感染状况,帽依赖性翻译就会大打折扣。内部核糖体进入位点(IRESs)可以绕过帽结构招募核糖体起始翻译,确保这样的条件下,适当的蛋白质合成。在此问题上,1月15日Science上报导了Weingarten-Gabbay等人的研究报告, 关于人细胞和病毒IRESs的系统发现,识别的mRNA(〜10%)和病毒(〜20%)与潜在的相当一部分由非依赖帽结构机制进行翻译。
IRESs首次发现是在小RNA病毒转录物的5'UTRs的复杂结构,以后被发现也出现在其他病毒和真核细胞的mRNA。IRESs与翻译起始因子相互作用,和RNA结合蛋白桥连,或与核糖体小亚基本身作用,在或接近起始密码子的地方导致核糖体定位,通常促进很少的翻译起始或根本没有核糖体扫描。 IRESs也已发现作为短序列元件能够与核糖体RNA形成碱基对,类似于在细菌翻译起始的Shine-Dalgarno序列。 IRESs缺乏共同的特点,难以生物信息学预测,需要用实验方法来识别它们。
在给定序列的内,检测IRES活性的标准测试是双顺反子报告因子的测定,其中候选序列置于两个开放阅读框(ORF)或“顺反子”之间,测试在直接下游顺反子的翻译能力。真核细胞IRESs在双顺反子法的典型的适度活动,再加上一些控制不好的结果发表的实验,已经引起有关IRESs在细胞mRNA的存在的怀疑。然而,IRES依赖性翻译的核糖体蛋白的存在支持IRESs 是mRNA翻译的潜在的重要效应物。本研究建立了一个高通量双顺反子报道基因测定体系,从细胞和病毒mRNA得到的、174个核苷酸长度数千个片断,量化了IRES依赖性翻译。一套583个人细胞和471个病毒的新型5'UTR IRESs出现了。适当的严格控制分析显示,它们既不是神秘的启动子构件,也没有剪接位点。
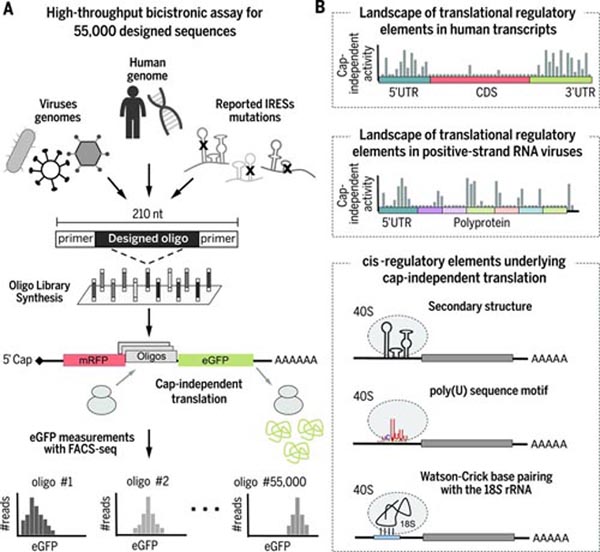
高通量的双顺反子分析对人和病毒的转录调控提供了新的证据。
(A)数以千计设计的寡核苷酸合成并克隆到双顺反子报告体系的文库。用eGFP来检测非帽结构依赖翻译活性,并进行荧光活细胞分选和深度测序(FACS-seq)。
(B)在人类和病毒中非帽结构依赖翻译由识别的顺式调控元件启动它们活性的情况。
研究发现数以千计的人和病毒序列与非帽结构依赖翻译活性,这提供了迄今已知序列数量50倍的增长。通过人转录本翻译的非帽结构依赖活性的无偏筛查展示在非编码区中转录开始的(5'UTR)调控元件的富集。然而,该研究也发现位于编码序列(3'UTR)的富集,这表明由核糖体被招募到3'UTR来增强上游序列的翻译。IRESS通过诱变实验揭示可分为两种类型:比较复杂的“全局”型IRESs,其不依赖帽结构的翻译驱动需要延伸的RNA的结构;“局部”IRESs通常由位于起始密码子60个核苷酸上游的短片断结构定义。
有趣的是,一些这样“局部”的IRES序列显示与18S rRNA基因H23和H26的螺旋区域互补。通过扫描寡核苷酸来看与整个18S rRNA基因序列中互补的双顺反子试验中,18S rRNA基因(核苷酸812至1233),包括H23和H26明显的区域被系统定义为有通过mRNA的互补性调节IRESs功能的活性。而“全局”IRESs可以通过与翻译起始或其它RNA结合因子的相互作用有助于核糖体招募。“局部”IRESs可能在很大程度上是基于Shine-Dalgarno这样的mRNA-rRNA的互补性起作用。
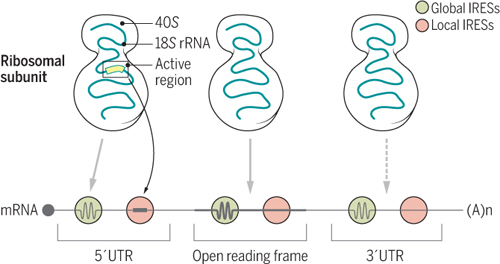
非帽依赖性翻译
两种类型的IRESs,“全局”(绿色)和 “局部”IRESs(粉红色),通常与18S rRNA基因互补的“活动区域”(黄色)。
该研究反应了在人和病毒中非帽结构依赖性翻译的广泛存在。建议了IRES介导的翻译在病毒RNA中是广泛存在的。有IRES活性的片段已经在几种病毒的多蛋白区被发现,暗示IRESs可能会从主要多蛋白的ORF中驱动病毒蛋白的独立表达。这反过来可能会刺激研究新的抗病毒策略。







