导读:美国麻省理工学院(MIT)的研究人员开发出了一种新型纳米粒子,能够按需求合成蛋白质。待这些“蛋白质工厂”粒子到达目标后,科学家就可以通过紫外线照射,启动蛋白质的合成。这些粒子能被用于传送可杀死癌细胞的小分子蛋白质,并最终形成诸如抗体等较大的蛋白质,激发免疫系统摧毁肿瘤。相关研究报告发表在近期出版的《纳米快报》杂志上。
科学家是在寻找打击转移性肿瘤的新方法时,萌生了生成“蛋白质构建粒子”的想法。这种肿瘤转移能从最初的癌变点转移至身体的其他部分,90%的癌症死亡皆源自于此。科研人员意图模仿在自然界中发现的蛋白质制造策略:细胞会把构建蛋白质的指令储存在DNA中,随后其会被复制到信使RNA中。信使RNA将运载蛋白质的蓝图至名为核糖体的细胞结构内,其可读取信使RNA传递的信息,并将它们翻译成氨基酸序列。氨基酸串在一起,便形成蛋白质。
研究人员表示,核糖体经过了数十亿年的自然进化,可被认为是生成蛋白质最完美的“机器”。他们设计的新型纳米粒子,能借助包含脂类(以形成粒子的外壳)、核糖体、氨基酸和酶类等合成蛋白质所需的混合物进行自组装;而生成某些特定的蛋白质也需要包括含DNA序列的混合物。
DNA被名为DMNPE的化合物所囚禁,但二者也能够可逆结合。当粒子暴露于紫外线环境时,这种笼状化合物将释放DNA,并进入蛋白质的生产周期。在此项研究中,粒子可被编程用于生产绿色荧光蛋白(GFP)或荧光素酶,基于小鼠的测试显示,在被紫外线灯照射时,可成功提示纳米粒子开始生产蛋白质,但其中可能涉及部分具有毒性的蛋白,它们可同时损坏癌细胞和健康细胞。不过,如果等粒子到达目的地之后再激活它们,则仅会在肿瘤处进行蛋白质生产,从而有效避免上述毒性蛋白产生的副作用,也不必担心合成的蛋白在传送过程中被迫分解。
但研究人员强调,还需要大量测试以证明纳米粒子能抵达它们在人体内的目的地,用于合成治疗性的蛋白质,并有望制成潜在的癌症治疗药物。该小组目前也在研究激活纳米粒子的其他方法,可能包括针对特定身体区域或细胞的、由酸度水平或多种生物条件所激发的蛋白生产等。

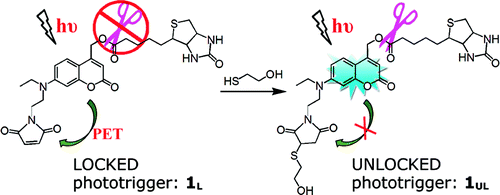
Target-Activated Coumarin Phototriggers Specifically Switch on Fluorescence and Photocleavage upon Bonding to Thiol-Bearing Protein
Qiuning Lin, Chunyan Bao, Shuiyu Cheng, Yunlong Yang, Wei Ji, and Linyong Zhu*
A new concept in which only the molecular target, such as a thiol-bearing protein, can activate the phototrigger has been demonstrated. Such target-activatable phototriggers comprise three parts: a 7-aminocoumarin phototrigger, an electron acceptor (maleimide) that efficiently quenches the coumarin excited state, and a caged leaving group attached to the coumarin. In the absence of mercaptans, photoinduced electron transfer between coumarin and maleimide effectively blocks both the fluorescence and photocleavage pathways. Thiol-bearing molecules, however, readily annihilate the electron acceptor and thus restore the phototrigger for photorelease of the caged cargo (e.g., biotin). Unlike traditional phototriggers, functional-group-activated phototriggers allow easy handling under ambient light, report specific bonding to the target, and enable photocleavage capability selectively at the binding site in situ, thus effectively positioning the photoreleased cargo at the target. Meanwhile, the unique feature of thiol-specific activation of the fluorescence and photocleavage make our new phototrigger a universal tool that can be used to identify accurately protein cysteine S-nitrosylation, a physiologically important posttranslational modification.