小肠上皮细胞小肠上皮由绒毛和隐窝两部分组成,在小肠表面像防护栏一样防止过多的细菌和有害的物质侵害小肠。正是因为这样,它就需要经常地修复。这个修复过程是由小肠干细胞引导的。小肠干细胞位于肠壁的特殊区域,肠隐窝 (肠腺)处;参与正常胃肠道上皮的维稳,以及损伤或应激下肿瘤生成的多种生理病理事件。因此研究小肠干细胞有着重要的意义。
胃肠道是再生能力最强的哺乳动物器官之一。在稳定的状态,为了抵消上皮细胞日常持续的消耗,小肠干细胞每24小时分裂一次产生的子细胞分化成小肠中各种上皮细胞。对于受伤的反应,通常认为小肠干细胞的行为上的改变是由包围干细胞区域的表皮细胞释放的调节信号引导的,而本周Nature的文章报导认为真实的画面可能更广。
两种类型的细胞被认为包含在小肠干细胞分化重大:叫潘氏细胞的分泌上皮细胞,分布于整个干细胞区域(见图2a),以及周围的结缔组织细胞,如间质细胞,和干细胞区域相邻。这两种类细胞型为干细胞提供了基本的生长和分化的因子,但他们是调节干细胞的行为的唯一的细胞类型吗?
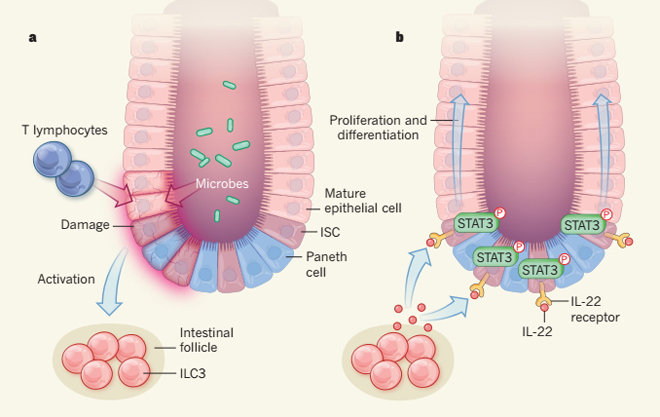
在1996年即在肠隐窝内发现数千滤泡含3型先天淋巴样细胞(ILC3s),并接近小肠干细胞和干细胞区域。ILC3s是造血细胞亚群的一部分,参与先天免疫,涉及到组织的保护和强化表面屏障。然而,在那时未发现滤泡中的ILC3s细胞,小肠干细胞和干细胞区域间的交流。
ILC3s产生白介素-22(IL-22),传递信号给非造血细胞的可溶性蛋白,研究表明IL-22可以指导上皮修复。事实上,之前的研究证明IL-22保护小肠干细胞不在移植物抗宿主病(GvHD)——造血干细胞移植术(HSCT)常见并发症中受损,这是一个用于治疗造血系统肿瘤的临床手术。在移植物抗宿主病中,免疫细胞T细胞从供体攻击接受者的组织,造成严重的炎症(如图2a)。移植物抗宿主病是骨髓移植后出现的多系统损害(皮肤、食管、胃肠、肝脏等)的全身性疾病。其表现最常见于肠上皮细胞和皮肤,可引起严重的器官损伤和死亡。
有证据表明,先天淋巴样细胞的作用可能是比一般认为更广泛的,在肠道中包括器官的维护和上皮修复。但仍不清楚ILC3产生的IL-22直接控制干细胞的行为,还是 IL-22可能作用于干细胞区域的细胞。为了解决这个问题,同时Lindermans和同事们使用了在体外培养的单个干细胞来源的微型肠道细胞。这些肠道细胞真实地模拟正常肠上皮细胞的主要功能,包括许多包含小肠干细胞和小肠干细胞来源的细胞隐窝,并且每个隐窝进入排列着成熟,吸收上皮细胞中央管腔。作者在IL-22的存在或不存在培养这些微型肠道细胞。IL-22大幅增加类器官大小和隐窝的形成,但不影响类器官的生成数。
IL-22作用于哪种类型的细胞?已知潘氏细胞为干细胞区域支持。然而,Lindemans等人的研究表明小肠干细胞,但不是潘氏细胞高水平表达IL-22受体蛋白,提示IL-22直接作用于小肠干细胞。作者发现IL-22的影响在缺乏潘氏细胞的类器官中能保持,提示潘氏细胞来源的信号与IL-22对小肠干细胞的影响不是一致的。此外,当小鼠输注供体T淋巴细胞诱导移植物抗宿主病时,提供 IL-22能改善疾病及防止小肠干细胞伴随肠道移植物抗宿主病的损失。因此,IL-22直接影响移植物抗宿主病介导的损伤后小肠干细胞池的再生,小肠干细胞介导的上皮修复不需要潘氏细胞产生的信号。
这项研究扩展了我们对小肠干细胞区域的认识,调整了先天淋巴样细胞群体在组织修复中以前不受重视的问题。以前的模型,认为只有基质细胞和干细胞的后代提供专门的干细胞区域信号。虽然在间质细胞支持小肠干细胞的作用的观点不应该被完全抛弃,但发现 IL-22直接作用于干细胞会改变研究人员干细胞区域的认识。在过去,造血细胞一直被认为是干细胞生长因子的受益者,但现在已很清楚,他们自己也能提供支持,维持上皮细胞的健康。
Lindeman和同事的数据将为未来的研究提供途径。ILC3s似乎直接或间接地感应上皮损伤和增加释放IL-22,但ILC3s如何感应这种损伤的分子机制仍有待确定。此外,目前还不清楚这IL-22依赖的分子通路如何调节干细胞。作者发现IL-22信号导致信号蛋白STAT3磷酸化,从而推动ILC3s细胞中的STAT3信号通路(如图2b)。然而,当干细胞缺乏STAT3时将会失去它们的干细胞潜能而不能产生类器官,妨碍对该信号通路的下游效应的分析。以后采用全基因组转录谱研缺乏和存在IL-22信号时的小肠干细胞可能揭示其相关的分子靶点。
考虑到应用IL-22可能有助于改善移植物抗宿主病,这很让人兴奋。有趣的是,释放来自供体的T淋巴细胞对宿主组织的并发症,也是一个理想的效果,因为细胞攻击肿瘤的造血能力对于根除疾病是至关重要。临床医生一直试图平衡造血干细胞移植的有益效果与移植物抗宿主病发病风险。发现IL-22用于治疗可以防止干细胞损伤,能最大限度地提高造血干细胞移植疗效。






