
在人类健康领域,我们期待一把特异的基因组手术刀来进行基因靶向治疗;在植物科学世界,我们需要一把便利的手术刀来构建各种突变株系;在微生物细胞催化环境,我们更渴望一把快捷的基因组手术刀来迅速缺失干扰基因,引导代谢流靶向目的产品。因此,作为目前基因组编辑的便捷CRISPR系统在生物界已是世人瞩目,CRISPR 1.0的Cas9手术刀也已经“战功赫赫”。
然而科学家们的脚步并未止步不前,9月24日来自剑桥大学的张锋团队再次掀起了基因组编辑的新浪潮,鉴定了新型的基因组手术刀Cpf1,也就意味着CRISPR 2.0的诞生。最新一期的Science也发表评论文章,深度讨论了这把新型手术刀。
1.Cpf1的发现历程
三年前,生物信息学专家Daniel Haft在埋头苦干地搜索微生物DNA序列的时候就发现了这样一类基因家族,但功能不明,他们给其中一个基因取了一个平凡的名字“Cpf1”。Haft 现在就任于美国马里兰州贝萨斯达的国家生物信息中心(NCBI),当他回忆这个基因时表示“完全没有想到这样一个功能不明的基因会被用于真核生物自定义基因组编辑”。
然而就在最新一期的Cell杂志上,来自剑桥大学的张锋团队证实了Haft曾经命名的Cpf1编码的蛋白可让CRISPR更加简单、有效而且强劲。他们梳理了NCBI中GenBank中DNA序列,得到结论:细菌使用多达5种不同形式的CRISPR,每一个都有一种不同的核酸酶,并猜测Cpf1家族也许比Cas9需要更少的RNA来编辑基因。张锋研究组最初鉴定了GenBank 中46个不同的Cpf1基因,并进一步证明有2个基因可以在人类细胞中发挥功能,切割他们靶向的任意一个基因。
2.CRISPR系统的现状
CRISPR系统开发了一个天然的过程,利用细菌保卫自身免受外来DNA入侵的本能。细菌产生一个蛋白质-RNA复合物, RNA负责识别外源DNA,蛋白质则作为核酸酶,切割入侵者的遗传物质,当然在这个过程中还需其他分子的辅助。研究者们曾经认为这个系统十分复杂,难以利用其进行基因组编辑。然后他们最终发现了一个无需太多RNA辅助的简单核酸酶Cas9 (Science, 2013)。到目前为止,CRISPR-Cas9系统已经为研究者们提供更加快速、简单的方式进行DNA的修饰,例如在水稻、动物、生化实验以及争议颇大的人类胚胎的遗传改造中都得到了应用。
在2013年,CRISPR的研究铺天盖地地发表出来,在各方面都得到了新的进展,当然也有很多难题未得到突破。CRISPR-Cas9并不是完美的,在切割中容易发生脱靶,而且标准的Cas9蛋白比较大,为转入被修饰细胞带来一定的困难。因此,十分有必要寻找新的替代核酸酶。正在这个时刻,Cpf1诞生了,为我们带来了CRISPR 2.0.
3.CRISPR 2.0 中Cpf1与Cas9有何不同?
当谈到这里,相信大家对新成员Cpf1的闪亮登场充满着好奇,那它会为我们带来哪些惊喜呢?
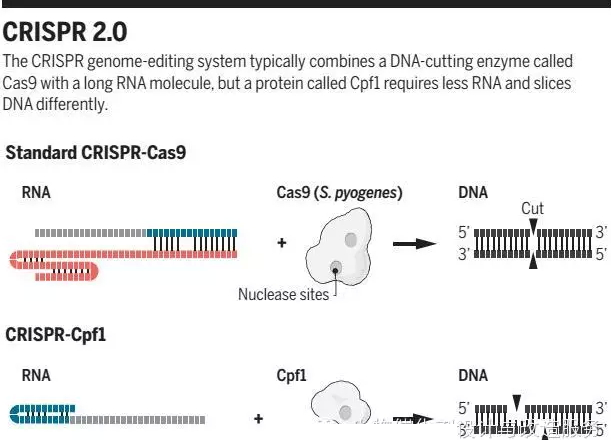
图1清楚地展示了两个版本CRISPR的区别,张锋团队发表的数据显示出两把基因组“手术刀”的不同之处。主要包含以下几点:
首先,两个核酸酶识别的PAM结构域不同。在引导序列靶向的DNA侧面一端的序列成为PAM,Cas9需要PAM包含鸟苷酸或者胞嘧啶,而Cpf1识别两个胸腺嘧啶。因此,如果收集能识别不同PAM的核酸酶,那么就能在基因组的更多不同位点实现修饰。此外,在有些胸腺嘧啶含量丰富的基因组编辑中,Cpf1将表现出更好的修饰能力,例如疟疾寄生虫Plasmodium falciparum的基因组中便富含胸腺嘧啶。
其次,Cpf1需要的RNA长度仅为Cas9的一半。这是一项十分明显的优势,为合成基因编辑复合物的工作减轻了压力;
再次,Cpf1与Cas9的切割方式不同。Cas9直接切割DNA双链,产生平末端,而Cpf1是一个交错切割的过程,产生有5bp外悬的粘性末端。目前还未知这样切割的机理是什么,或许更有助于精确切割,尤其在不分裂的细胞中,如体细胞与脑细胞。然而也有可能干扰细胞的两种DNA修复机制的比例,导致修复不够精确。
当然这些发现只是一个新的开始,Cpf1蛋白还有很多未解释的疑问,例如靶向特异性与切割机理仍有待研究。然而可以猜想,细菌的免疫机制或许能为我们带来更多的遗传编辑工具,尤其在未解析的免疫机制中能开发出什么样的分子工具,我们或许是难以想象的。也许Cpf1只是一个序幕?是否还有更多的革命性进展即将揭晓?我们将持续关注……







