IncuCyte ZOOM:第二代长时间动态活细胞成像及数据分析系统的特点和应用
(第二版)
上海典奥生物科技有限公司(TekonBiotech(Shanghai)Ltd.)
目前,大部分的细胞检测方法采用的仍然是传统的终点法——仅仅给出最终结果,而且往往需要标记细胞和破坏细胞。这种方法无法得到细胞在生长时的真正状态,也无法对细胞的生长过程做出动态的监测和分析。美国Essen公司开发了第二代长时间实时动态活细胞成像分析仪——IncuCyte ZOOM,用一种非侵入式的方法,记录活细胞的实时生长状态,并在成像的同时进行定量分析。这种成像方法,被称为“定量实时细胞成像”(Quantitative Live-cell Imaging),无需设置实验终点,细胞在培养的同时进行实时成像和定量分析,并提供多种应用模块,可远程控制,扩充了用户记录和理解细胞形态、细胞生长和细胞行为的途径。
美国Essen公司的IncuCyte ZOOM是长时间、实时动态、非伤害式的活细胞成像分析平台。仪器分为显微成像器和控制器两部分,显微成像器可放置于培养箱中,中间放置多种规格尺寸的标准耗材(板、皿、瓶及载玻片均可),在其下方有显微照相设备,通过自动对焦、自动拍摄,对培养细胞进行连续的监测,并通过联网的电脑进行远程控制、数据读取与分析。系统可自动收集每个时间点的相差图像和红/绿荧光图像。用户除了可以得到各种格式的图像或动态录像外,还可以得到由系统软件自动依据覆盖度(Confluence,也翻译成融合度、饱和度)和计数分析(Cell Count)生成的基于图像数据的图表,以显示细胞的变化及趋势。如显示细胞增殖的覆盖度vs时间图表,显示划痕实验的相对伤口密度vs时间图表,显示新生血管的血管长度vs时间图表,或显示神经生长的神经突长度vs时间图表。
IncuCyte物镜可选择4×,10×,20×,可由用户自行更换。在4倍物镜下对6-384孔微孔板均可进行全孔成像。安装物镜的接头还可安装记号笔(MarkingTool),用软件操作,即可在容器底部进行物理标记,方便后续实验观察,见图2。

图1:培养箱中的IncuCyte ZOOM

图2:上左图:软件标记,上右图:用记号笔在培养皿底部进行物理标记,下图:记号笔和物镜
IncuCyte的优势如下:
1)培养的细胞用高清晰度相差显微镜或荧光显微镜直接监测,为非破坏性的监测,细胞不用染色便可以观察监测,影像效果好;
2)培养环境由商用培养箱提供,监测过程中细胞无需离开培养箱,不用担心培养条件的改变对细胞的影响;
3)真正的长时间的动态活细胞成像,可达数周或数月;
4)高清晰度相差成像能消除微孔板的弯液面缺陷,且没有传统显微系统的光晕问题,可以在384微孔板内监测细胞形态;
5)图像处理软件自动依据覆盖度和计数分析,量化细胞增殖,自动输出细胞生长曲线和IC50、EC50值;
6)实时监控,可改变传统的“终点法”实验方法,数据丰富,更准确、更灵活;
7)高通量,可同时监测6块标准规格的细胞培养板/皿/瓶,细胞在384微孔板内实验,可以减少宝贵的药品消耗,见图3;
8)支持超过200种的标准培养容器,无需特殊的培养容器,节约后期实验成本;
9)可远程监控,进行数据读取和分析,无需反复出入细胞房,避免了潜在的污染隐患及人工出入观测之麻烦。
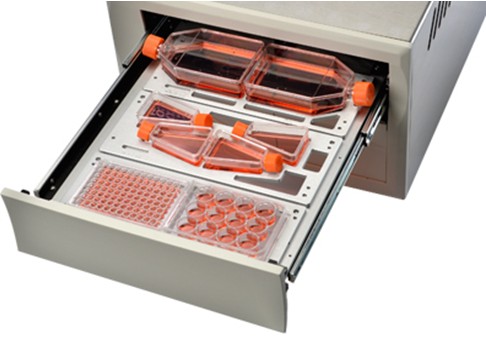
图3:IncuCyte内部结构,支持超过200种标准培养容器,可同时观察多达6块微孔板
图4是IncuCyte记录的细胞增殖的高清晰度相差图像和覆盖度vs.时间的增殖曲线,黄色为软件对细胞图像的分割显示。IncuCyte也可对荧光图像生成细胞数目vs.时间的增殖曲线。最后图像会被导出成单独的JPEG文件或视频。

图4:IncuCyte记录的细胞的相差图像和增殖曲线
IncuCyte的主要软件功能:
1)用户可以在任何一台联网的计算机上操控仪器,而无需反复拿进拿出标本及出入细胞房,这使IncuCyte成为了一个“虚拟的培养箱”。
2)IncuCyte最好的特点之一就是直观的软件界面设计。用户可以在软件的操作界面上定义耗材的类型、拍摄的时间、位置及视野个数,见图5。
3)支持在长时间拍摄过程中插入其他拍摄任务继续进行拍摄,以充分利用仪器。
4)IncuCyte可以自动对焦,自动进行图像收集。对得到的图像也可以进行亮度、尺寸、对比度的显示控制。可以设置细胞尺寸、偏心率等参数,过滤背景杂质。
5)用户可以自定义样本信息,进行分组分析,并可以电子化标记器皿,设定关键词,必要时可用设定的关键词搜索数据库,方便查询过去任何时间得到的图像和数据。
6)用户还可以直接从软件中抓取图像、图表、曲线至Word、Excel、PowerPoint和Email中。生成的所有数据均可存档,并且数据和图表可以打包封存,便于用户带回家分析。
7)IncuCyte ZOOM的新特性包括多荧光图像处理模块和新的相差成像处理模块。
8)ZOOM还设计了新的数据库,使用户能更容易查找和检索实验数据。
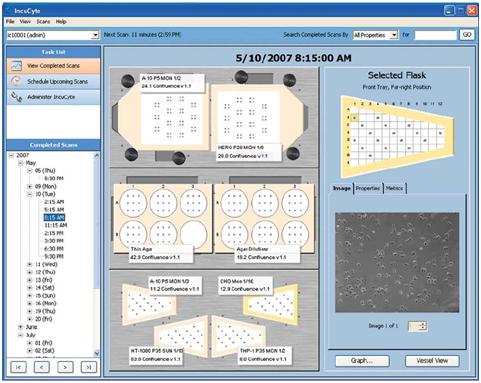
图5:软件操作界面
IncuCyte的基础应用包括(无需套件):
1)监测细胞增殖(Proliferation):通过实时动态成像,对细胞增殖进行非侵入性的、定量的分析;
2)细胞培养质控(Cell Culture QC)/细胞培养优化(Cell Culture Optimization):通过实时动态成像,可生成基于细胞覆盖度和细胞个数的动态生长曲线;
3)监测细胞毒性(Cytotoxicity):将染料和细胞混合然后监测,操作者可离开,是基于染料的实验;
4)监测细胞凋亡(Apoptosis):将凋亡试剂和细胞混合然后监测,操作者可离开,是基于染料的实验;
5)监测报告基因(Reporter Gene):用荧光蛋白标记细胞,细胞无需裂解,可获得实时动态数据;
6)监测干细胞生长及重编程(Stem Cell Monitoring& Reprogramming):可实时监测干细胞生长的全过程及重编程现象;
7)稀释克隆(Dilution Cloning):可实时跟踪单细胞生长成克隆的全过程;
8)三维肿瘤球体成像(3D-Spheroid):可自动计算3D肿瘤球体的生长和收缩,实时动态地定量球体参数;
9)免疫细胞杀伤(Immune Cell Killing):可实时动态观察和分析免疫细胞介导的对肿瘤细胞的杀伤作用;
10)免疫细胞聚集及增殖(Immune Cell Clustering andProliferation):可实时动态观察和定量分析免疫细胞的聚集和增殖。
IncuCyte开发了很多满足特殊应用的套件,配有特别设计的定量分析软件。需要套件的应用包括:
1)监测细胞迁移(Cell Migration)/细胞侵袭(Cell Invasion):配套高度一致性的96孔伤口划痕工具Wound Maker,实时动态监测伤口的愈合过程,可得到细胞进行划痕迁移运动的定量指标;
2)监测趋化运动(Chemotaxis):配套专门的96孔板,定量分析贴壁细胞和悬浮细胞在趋化因子作用下的类似Transwell方法的细胞迁移(Migration)运动;
3)监测血管新生(Angiogenesis):使用通过验证的血管新生试剂盒,具有动态分析血管新生的定量指标;
4)神经生长跟踪(Kinetic NeuroTrack):可分别在相差和荧光成像基础上定量分析神经元细胞的神经突的生长状况。
以下我们重点讲述基本应用(细胞毒性、细胞凋亡、报告基因、干细胞生长、稀释克隆、三维肿瘤球体成像、免疫细胞杀伤、免疫细胞聚集和增殖)和需要套件的应用(细胞迁移、细胞侵袭、趋化运动、血管新生和神经跟踪)。细胞增殖、培养质控、细胞培养优化的原理见图4即可。
IncuCyte的无需套件的主要应用:
(一)监测细胞毒性(Cytotoxicity)
发生细胞毒性时,细胞膜会破裂,这时使用非渗透的染料,如YOYO-1或CellTox Green就可以将发生细胞毒性的细胞染色,然后用IncuCyte进行观察。
关键特性:1)运用NucLight慢病毒试剂标记健康细胞,用细胞非渗透性DNA染料标记发生毒性细胞,同时监测细胞增殖和细胞毒性;2)可区别细胞毒性(Cytotoxic)和细胞抑制(Cytostatic);3)可将数据导出到第三方软件,计算EC50和IC50;4)可通过获取4×、10×或20×的高清晰度相差图像,跟踪细胞形态,确认细胞是否死亡;5)过程免洗,混合染料,然后读数即可;6)可观察多种化合物和药物对细胞的毒性作用。
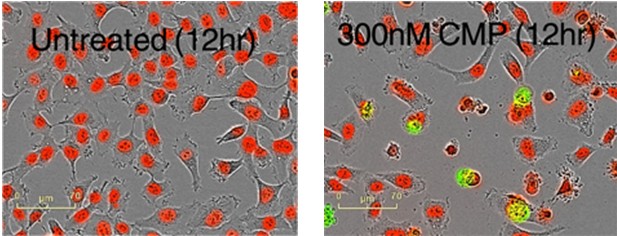
图6: HT-1080细胞用NucLight-Red标记,并在YOYO-1存在的条件下用喜树碱(Camptothecin)处理。高清晰度相差图像和荧光图像用于确认细胞是否死亡。
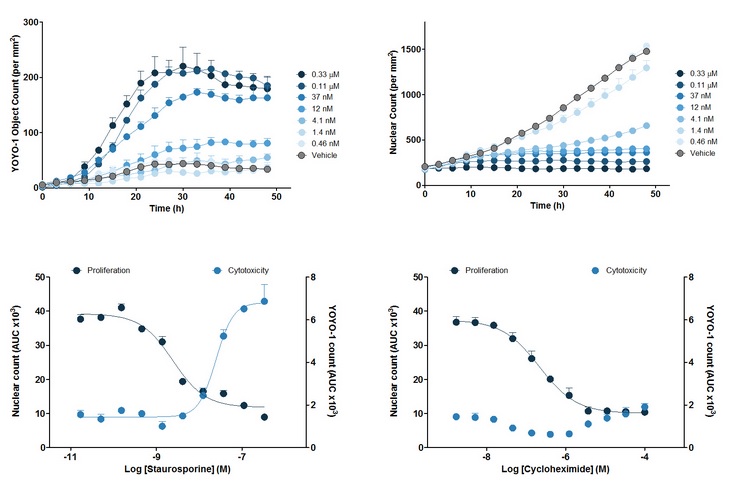
图7:上两图:十字孢碱(Staurosporine)作用在红色荧光蛋白标记的HT-1080细胞上的时序过程。上左图表示YOYO-1标记的细胞死亡个数随时间的变化;上右图表示红色荧光蛋白标记的细胞增殖随时间的变化。下两图:对上两图的曲线下面积(AUC)进行分析,下左图表示十字孢碱作用下的细胞毒性和增殖,下右图表示放线菌酮(Cycloheximide)作用下的细胞毒性和增殖。细胞毒性用每平方毫米的YOYO-1标记细胞个数表示,细胞增殖用每平方毫米的红色细胞核个数表示。曲线下面积(AUC)被用来计算IC50值和EC50值。
(二)监测细胞凋亡(Apoptosis)
CellPlayerCaspase 3/7细胞凋亡试剂是DNA染料和Caspase3/7酶的底物的连接物。如果细胞发生Caspase3/7途径的凋亡,当将此试剂加入培养基时,细胞膜上的活化的Caspase 3/7酶就会降解此连接物,使原来不发光的染料从连接物中脱离下来,与细胞的DNA双链结合,从而发出黄绿荧光,被IncuCyte检测到。这样就可以用IncuCyte观察细胞的凋亡全过程。
关键特性:1)用NucLight慢病毒试剂标记健康细胞,用Caspase 3/7试剂标记凋亡细胞,同时监测细胞增殖和细胞凋亡;2)直接向细胞中加入Caspase 3/7试剂,免洗操作,可检测由内在或外在途径引起的细胞凋亡;3)可将数据导出到第三方软件,计算IC50和EC50。4)用4×、10×或20×物镜观察高清晰度相差图像,以确定细胞的死亡;5)高通量,可进行96-和384-孔板的实验,每次可观察6块微孔板;6)可观察多种化合物和药物对诱导细胞凋亡的作用。
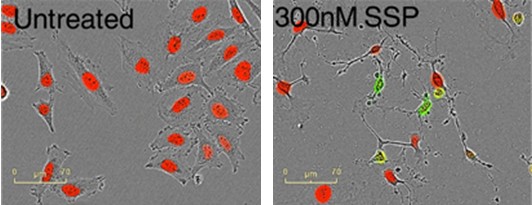
图8:红色荧光蛋白标记的宫颈腺癌细胞在有Caspase 3/7试剂的条件下用不同浓度的十字孢碱(Staurosporine,SSP)处理。可以准确计量红色细胞核个数和绿色荧光个数。可以观察到伴随Caspase3/7的绿色荧光,细胞发生皱缩、膜起泡等凋亡现象。
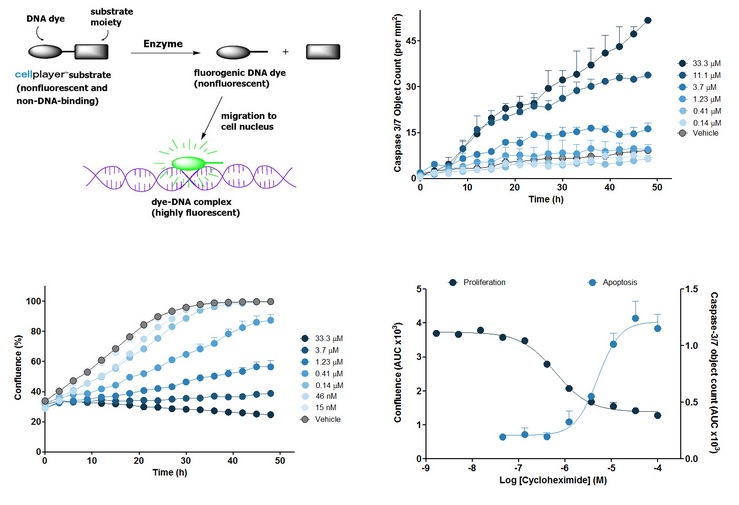
图9:上左图表示Caspase 3/7试剂的原理。其他三张表示不同浓度的放线菌酮(Cycloheximide)处理HT-1080人纤维瘤细胞的时序性图表。上右图表示用每平方毫米的Caspase 3/7绿色荧光个数表示的细胞凋亡,下左图表示用覆盖率(Confluence)表示的细胞增殖。下右图表示从上两张图中的曲线下面积(AUC)得到的凋亡和增殖的浓度响应曲线。平均AUC可用来计算EC50和IC50。
(三)监测报告基因(Reporter Gene)
细胞用含GFP/RFP的载体转染,GFP/RFP的上游插入需要研究的启动子。这样就可以通过IncuCyte观察GFP/RFP的时序性表达的荧光强度和荧光细胞个数,从而监测通路刺激(如NF-κB)的作用、启动子的活性或报告基因的表达活性。
与传统的终点荧光素酶方法对比,IncuCyte的关键特征在于:1)数据丰富:96-或384-孔的实时动态数据可获得终点法无法获得的洞察能力;2)节约成本:无需裂解,无需荧光素酶法需要的终端反应底物,节省时间和花费;3)方便:实时动态读数使用户能在单个的实验中优化信号窗,无需事先决定何时终止实验;4)敏感:可得到每个条件下的多个时间点数据,增加了实验的定量性和稳定性;5)可定制:用户可根据需要定制启动子,修改反应体系,监测药物对报告基因的作用。

图10:HEK293细胞用商用的报告基因(pNF-κB-rhGFP)短暂转染后的荧光图像,该图像是用rhTNF-α(11ng/ml)处理细胞20hr后拍摄的。

图11:在用rhTNF-α刺激HEK293细胞后,NF-κB驱动的rhGFP报告基因的表达(n=5孔)。在用pNF-κB-rhGFP报告基因转染的HEK293细胞中,用3倍稀释的rhTNF-α处理。图像以15min为间隔获得。图像表示外在的rhTNF-α的浓度越高,细胞的荧光覆盖度就越大,表示细胞内部的NF-κB的活性越强。
(四)干细胞监控和重编程(Stem Cell Monitoring &Reprogramming)
可监控干细胞的重编程和分化现象,用高清晰度相差图像确认和跟踪克隆的形成,可回溯以往的图像。
关键特性:1)可用高清晰度相差图像确认和跟踪克隆的形成,而无需将其取出培养箱,全孔成像可观察到孔的边缘;2)可监控和计算转导效率和重编程效率;3)可通过软件,用记号笔在容器底部进行物理标记,对克隆进行定位和跟踪;4)降低人工成本,提高工作效率。
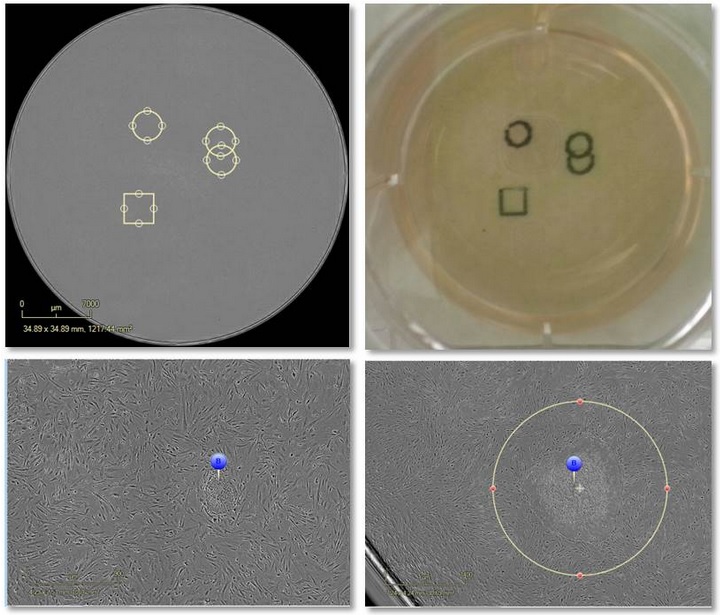
图12:上左图为对感兴趣的区域进行电子标记,上右图为用记号笔在培养皿底部进行物理标记。下左图为新兴克隆的标记,下右图为用软件选择克隆进行物理标记。
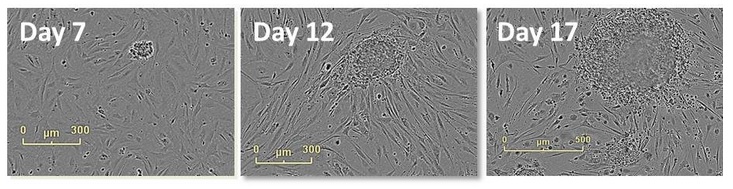
图13:用高清晰度相差成像跟踪克隆的形成
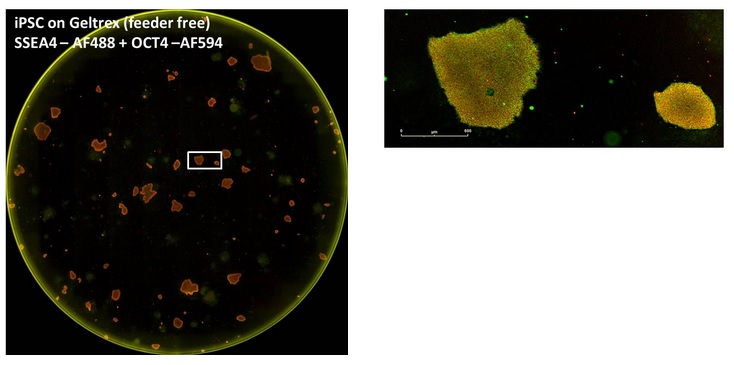
图14:用细胞表面标记物确认多能性。来源于成人皮肤成纤维细胞的诱导多能干细胞生长于鼠胚胎成纤维饲养细胞上,用双重标记确认多能性。双重标记为:“SSEA4一抗+Alexa Fluor 488二抗”和“OCT4一抗+AlexaFluor 594二抗”。上左图为得到的全孔图像,上右图为将全孔图像中选定的克隆放大,均表达两种细胞多能性的标记物。
(五)稀释克隆(Dilution Cloning)
对全孔无标记图像,自动扫描克隆,确认单克隆状态,整合的图像处理软件可以确认包含新兴克隆的孔,并快速确认感兴趣的克隆。
关键特性:1)从办公桌上就可以快速浏览耗材和96孔板来确认克隆,无需用显微镜一个个观察;2)用时序性图像可以确定克隆来源于单个细胞;3)高清晰度相差成像可生成从96孔板到35mm培养皿的全孔图像,孔的边缘也能清楚看到;4)可自动鉴别含有克隆的孔,用克隆标记工具可以对克隆进行定位;5)可对克隆进行快速孵育和扩张,并得到克隆的生长指标。
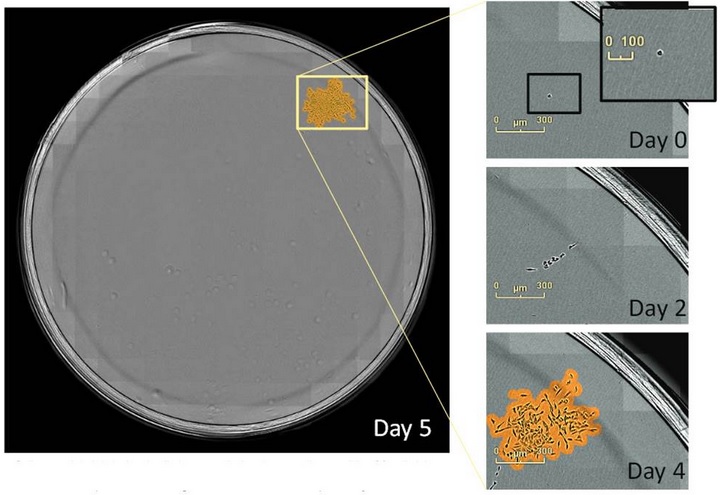
图15:可用IncuCyte软件快速扫描、定位和监控克隆,跟踪它们随时间的变化。上图中的克隆就是从单个细胞形成的。
(六)三维肿瘤球体生长(3D-Spheroids)
IncuCyte可跟踪和定量非贴壁的三维肿瘤球体的形成、生长和收缩。
关键特性:1)简单的96-或384-孔实验方案,使用低成本、圆底、低吸附性的微孔板;2)软件可自动获取、分析图像,数据可导出计算EC50和IC50;3)可在同一个孔中,用同样的试剂平行进行2D和3D的实验;4)用荧光面积或荧光强度指标,监控和测量肿瘤球体随时间的生长和收缩;5)培养上清可用来测量ATP、乳酸或其他物质浓度。

图16:时序图像显示稳定表达核RFP(A549 NucLight Red)的A549人腺癌细胞的生长和皱缩。肿瘤球体分为空白对照组和十字孢碱处理组(细胞接种后的第三天为t=0,用1µM Staurosporine,SPP处理)。红色图像是高清晰度相差图像和荧光图像的叠加。对照组显示肿瘤球体的尺寸和荧光强度均增加,SPP处理过的肿瘤球体的尺寸皱缩,荧光变暗。蓝色图像是机器分析时的伪彩。
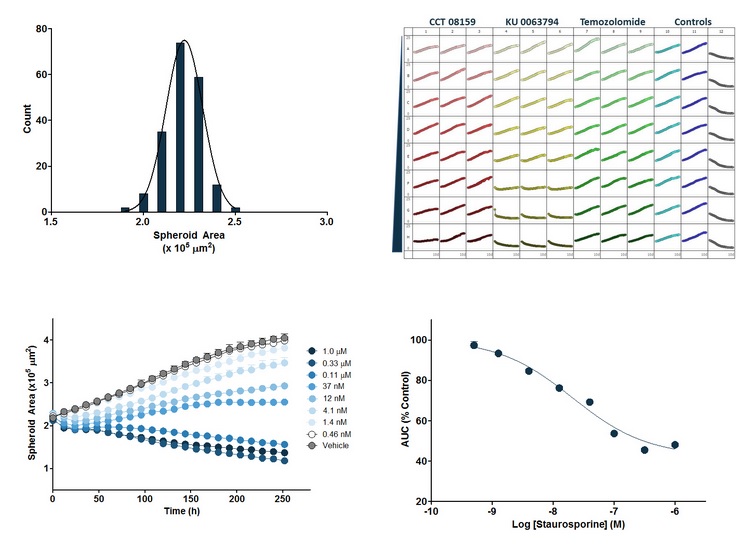
图17:上左图:尺寸柱形图,192个(2块96孔板)A549 NuLightRed肿瘤球体在t=0(细胞接种后三天)时的面积(平方微米)。上右图:微孔板图,用实验试剂处理的该肿瘤球体的增殖时序曲线(三重复),从t=0开始10天。横坐标为时间(h),纵坐标为荧光覆盖率(%)。下左图:用不同浓度的十字孢碱(SPP)处理细胞的时序性曲线。横坐标为时间(h),纵坐标为肿瘤球体的荧光面积(平方微米)。下右图:SPP的浓度反应曲线:对下左图的曲线下面积(AUC)进行分析。横坐标为SPP浓度的对数值,纵坐标为肿瘤球体的荧光面积的AUC。
(七)免疫细胞杀伤(Immune Cell Killing)
免疫细胞能够识别并杀死肿瘤细胞是人宿主防御机制的关键组成之一。基于抗体的细胞介导的细胞毒性(ADCC)和T细胞杀伤是细胞介导的免疫反应的两种机能。这两种过程都包括:对免疫细胞群落(如自然杀伤细胞NK或有细胞毒性的T淋巴细胞CTL)的刺激,然后有活性地溶解目标细胞。理解免疫细胞和癌症细胞的相互作用,保持及促进免疫系统抗击和消除肿瘤细胞的能力是目前研究的热点之一(“癌症免疫治疗”或”免疫肿瘤学“)。
关键特性:1)目标肿瘤细胞和免疫细胞(如T细胞,人外周血单核细胞,PBMCs)共培养;2)通过加入免洗的Caspase3/7凋亡试剂直接检测肿瘤细胞的死亡;3)自动图像分析可选择性地对肿瘤细胞死亡进行定量,通过NucLight Live-Cell慢病毒标记试剂还可以对肿瘤细胞进行标记和计数,计算肿瘤细胞的增殖;4)实时成像可揭示免疫细胞和癌症细胞间的动态的相互作用,可分析细胞形态;5)免洗的96/384实验设计,适合做药物筛选。
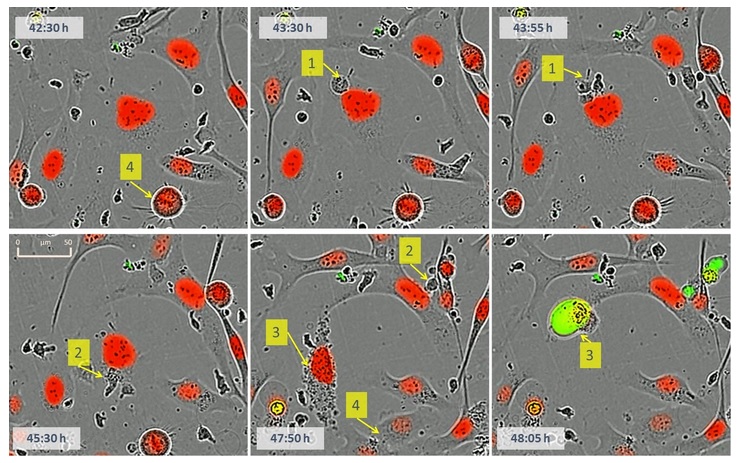
图18:动态观察免疫细胞和肿瘤细胞的相互作用。标识1:一个小的具有细胞毒性的T细胞和一个较大的标记的肿瘤细胞(红色)物理接触;标识2:肿瘤细胞受到具有细胞毒性的T淋巴细胞的攻击;标识3:肿瘤细胞细胞核成颗粒状,然后马上被Caspase 3/7试剂染色(绿色),细胞核浓缩,细胞死亡;标识4:肿瘤细胞进行有丝分裂,一个细胞变成两个。
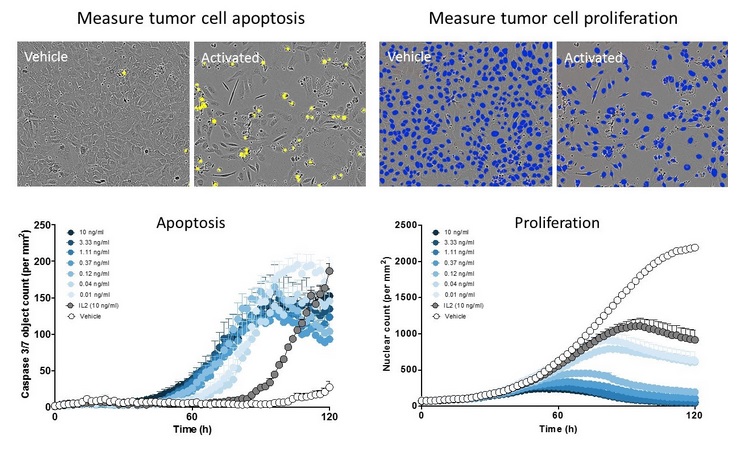
图19:实时动态测量肿瘤细胞死亡和增殖。IncuCyte软件可直接检测凋亡的肿瘤细胞(绿色对象,伪彩为黄色),并且对活的肿瘤细胞进行实时计数(用NucLight red标记细胞核,伪彩为蓝色)。实时动态的数据分析揭示药物的时序作用。
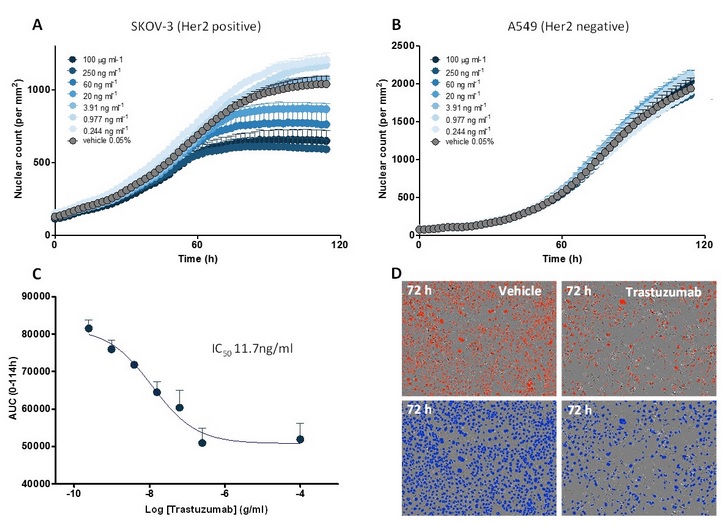
图20:ADCC(基于抗体的细胞介导的细胞毒性):Trastuzumab(Herceptin)诱导的免疫细胞对SKOV-3卵巢癌细胞的杀伤作用。PBMCs与SKOV-3 NucLight Red(Her2阳性)或A549 NucLight Red(Her2阴性)的肿瘤细胞共培养。(A):SKOV-3肿瘤细胞发生trastuzumab诱导的基于浓度的增殖抑制;(B):A549不发生基于浓度的增殖抑制。(C):trastuzumab对SKOV-3细胞的增殖抑制的浓度响应曲线。(D):加入和没加抗体的图像,上图:未处理,下图:用蓝色伪彩标出细胞,均成像于药物加入72h后。
(八)免疫细胞聚集和增殖(Immune CellClustering and Proliferation)
在免疫反应中,免疫系统中激活的细胞,如T淋巴细胞,会发生快速的增殖以反抗感染和疾病。活化的免疫细胞之间也会发生相互作用(如T细胞与表达抗原的细胞间的作用,T细胞相互间的作用等)。这些细胞数目的动态变化和细胞-细胞相互作用是调控免疫反应的效果和程度的基础。理解免疫细胞活化、增殖和调控的机能是开发新型和高效抗肿瘤免疫治疗的关键。
关键特性:1)可实时动态的观察和自动定量分析免疫细胞的相互作用和增殖;2)能在培养箱中监控细胞行为的全过程;3)无需标记细胞,动态测量;4)免洗操作,无需悬浮细胞,无需对抗体进行标记;4)可观测和计算药物对免疫细胞聚集和增殖的影响;5)与传统的流式细胞仪方法和终点生化测量方法兼容,在IncuCyte实验结束后收集细胞或上清液即可。

图21:非标记检测T细胞的聚集。用anti-CD3抗体和IL-2活化PBMCs,可诱导T细胞的聚集或“clustering”。IncuCyte软件可准确定量细胞随时间的聚集(图中蓝色伪彩)。
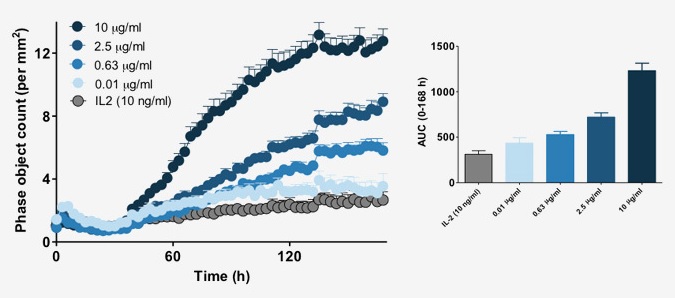
图22:计算实时动态的细胞聚集。自动的时序性分析可揭示药物处理的影响。在IL-2(10µg/ml)存在的条件下,将anti-CD3抗体的浓度从0.01增加到10µg/ml可促进T细胞的聚集。
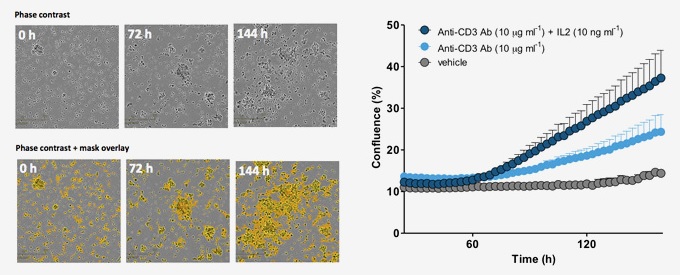
图23:实时无标记监测PBMC的增殖。左图:IncuCyte自动定量用anti-CD3抗体和IL-2活化的PBMCs的增殖(黄色伪彩)。右图:三种条件下的PBMCs的增殖的时序曲线。
IncuCyte的需要套件的主要应用:
(九)监测细胞迁移(ScratchWound Cell Migration)
IncuCyte的Migration模组中独有市面上唯一的96孔划痕器(WoundMaker Tool),仅需一个按钮,就可以在96孔微孔板上生成96个均匀一致的划痕,然后用IncuCyte记录划痕愈合(Wound Healing)的实时动态全过程。
IncuCyte可以从预设的时间点来获得图像并转换成录像。系统记录了初始的WoundMask,然后随着Revised Wound Mask的生成,系统持续记录图像来跟踪划痕的愈合。用户可以很直观地通过2D的迁移和3D的侵袭图像来观察细胞形态的变化,并对两种细胞运动方式进行对比。在我们的高清成像基础上,细胞无需标记就可以进行观察。使用专利的算法,可以得到综合的基于时间推移的持续性图像采集指标,包括:相对伤口密度(Relative Wound Density)、伤口覆盖度(WoundConfluence)、伤口宽度(Wound Width),用来计算EC50和IC50,迁移率,使实验结果的定量性和重复性更好。所有时间点的指标都可以通过细胞图像和录像进行验证。
细胞迁移的关键特征:1)可在同一块96孔微孔板中通过4×、10×或20×的物镜测量2D的细胞迁移和3D的细胞侵袭,并进行对比;2)在每个时间点可生成576个孔的数据(6×96);3)可对超过30种不同的原代细胞系(primary cells)和长生细胞系(immortalised cells)进行非标记的细胞迁移定量测定,包括HUVEC细胞和肿瘤细胞系;4)可自动分析测量相对伤口密度、伤口覆盖度和伤口宽度;5)可用图像和时序录像验证药理学作用;6)可用NucLight或CytoLight RFP/GFP标记细胞,定量监测共培养的细胞迁移和侵袭。
图24:左图:HT-1080人纤维肉瘤细胞的迁移曲线,横坐标为时间(h),纵坐标为96孔的RDW(%)的平均值。右图在8mg/ml Matrigel中的细胞侵袭图像;右图:HT-1080细胞的96个划痕的初始伤口宽度的分布图,表明伤口宽度基本一致。
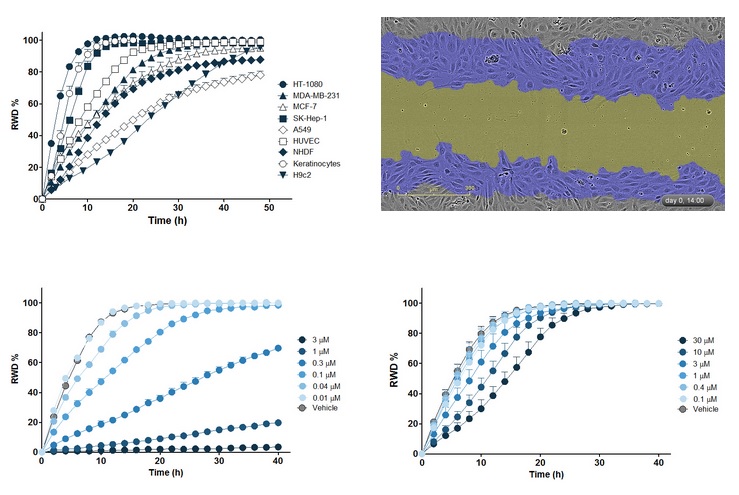
图25:上左图:不同细胞系的迁移运动曲线对比,横坐标为时间(h),纵坐标为相对伤口密度(RWD,%,RWD=0表示没有发生迁移)。上右图:HUVECs细胞迁移14h后的相差图像。蓝色区域表示在14h中细胞迁移覆盖的区域,黄色区域表示14h后的Wound Mask区域。下左图:HT-1080细胞用不同浓度的细胞松弛素D(Cytochalasin D)处理后的迁移运动曲线。下右图:HT-1080细胞用不同浓度的渥曼青霉素(Wortmannin)处理后的迁移运动曲线。横坐标为时间(h),纵坐标为RWD(%)。注意:两种药物得到的细胞迁移曲线不同。
(十)监测细胞侵袭(Scratch Wound Cell Invasion)
划痕实验的细胞侵袭和细胞迁移具有类似的实验过程,区别在于:细胞迁移的细胞种在细胞外基质(Extracellular matrix,ECM)上,划出伤口后直接进行培养观察;而细胞侵袭的细胞种在ECM上,划出伤口后又铺上一层ECM,然后进行培养观察。所以细胞迁移是在2D环境下进行的,而细胞侵袭是在3D环境下进行的。
细胞侵袭的关键特性:同细胞迁移。

图26:左图:HT-1080人纤维肉瘤细胞在Matrigel(100µg/ml)上迁移2h的相差图像。右图:HT-1080细胞在Matrigel(8mg/ml)中侵袭24h的相差图像。请注意:两种情况下的细胞形态有较大差异,侵袭图像还显示了单个细胞穿过Matrigel的路径。

图27:上图表示三种细胞在Collagen-1底层胶(300µg/ml)上的迁移和在Collagen-1基质(0,1,2,3mg/ml)中的侵袭。请注意:不发生侵袭的MCF-7人胸腺癌细胞不能穿过ECM,但在没有ECM时可以发生迁移。
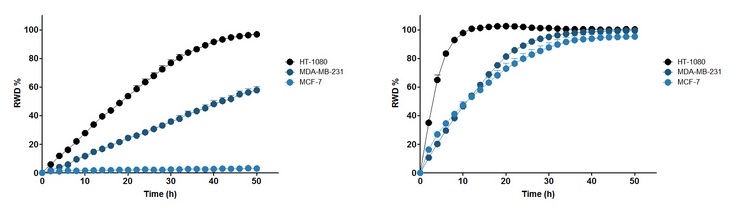
图28:上左图:三种细胞穿过Matrigel(8mg/ml)的细胞侵袭曲线。上右图:三种细胞在Matrigel(100µl/ml)上的细胞迁移曲线。横坐标为划痕后时间(h),纵坐标为RWD(%)。请注意:MCF-7细胞只发生迁移,不发生侵袭。

图29:共培育细胞在Matrigel中的侵袭图像。细胞分别是:CytoLight Red标记的HT-1080细胞和CytoLight Green标记的MCF-7细胞。可见HT-1080细胞发生侵袭,而MCF-7细胞不发生侵袭(没有进入划痕区域)。
(十一) 监测趋化运动(Chemotaxis CellMigration)
趋化运动(Chemotaxis)是细胞在化学刺激(趋化因子)作用下的直接运动,是免疫反应、肿瘤转移、伤口愈合和血管形成等过程的主要组成步骤。基于细胞的趋化运动对进一步研究这些生物过程十分关键。

图30:趋化运动专用的ClearView96孔细胞迁移微孔板。该板由三部分组成:上层为盖子,中层为种植细胞的板子,下层为试剂槽。中层的板子上,每个孔中都有光学透明的膜,上面用激光打出很多直径为8µm的精确的小孔。实验时,细胞种入中层板孔中的膜上,趋化因子(Chemoattractant)注入下层板的试剂槽中。然后放入培养箱观察细胞在趋化因子作用下穿过小孔的运动。

图31:上两图:T细胞在膜上方的图像(Top-only analysis),黄色是相差图像的伪彩(mask)。上左图:t=0时刻膜上方的细胞;上右图:t=30h时受趋化因子200nM SDF-1α作用,膜上方的细胞大量减少。下两图:HT-1080细胞在膜下方的图像(Top/Bot analysis),桔红色是相差图像的伪彩(mask)。下左图:t=0时刻膜下方的图像,此时还没有细胞;下右图:t=48h时受趋化因子10%FBS作用,大量细胞转移到膜的下方。
现有细胞趋化运动的缺点和不足:1)无法将细胞的实时运动可视化(如:Boyden chamber Transwells);2)通量低,实验方法对技术要求高(如:微流体设备);3)缺少整合的定量分析。
IncuCyte Chemotaxis解决方案的优势:1)可将实时动态的细胞迁移过程可视化,并进行全自动分析;2)高度可重复的96孔动态实验,适合进行筛选;3)细胞用量低,适合用于珍稀细胞、昂贵细胞或原代细胞群。ClearView板每孔需要的细胞数目是2,000-20,000个/孔,而Transwell方法每孔需要的细胞数目最少为150,000个/孔;4)是表面介导的迁移过程,可表现表型的细节信息;5)能更长时间维持膜两侧的趋化因子的浓度梯度,ClearView方法维持浓度梯度超过72h,而Transwell方法4h后可观察到明显的浓度梯度下降。
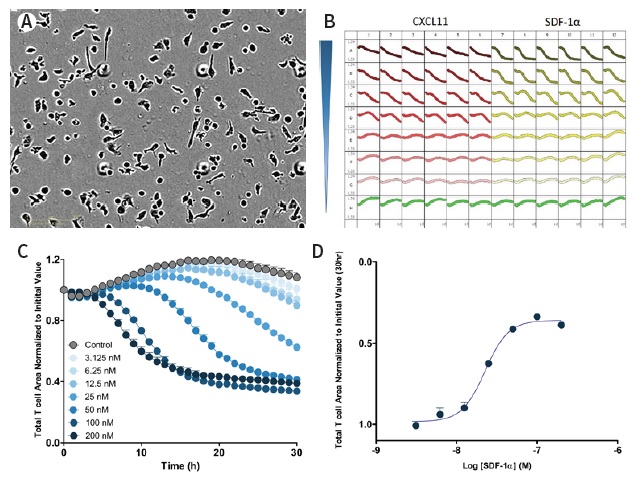
图32:实时96孔趋化运动的图像和数据分析。左上图:IncuCyte ClearView 96孔板上的T细胞的高清晰度相差图像。右上图:T细胞对不同浓度的趋化因子CXCL11和SDF-1α的96孔板曲线。左下图:T细胞对不同浓度的趋化因子SDF-1α的剂量响应曲线,纵坐标是板上层的细胞面积。可见浓度越大,曲线下降越快,说明上层细胞快速穿过小孔。右下图:对剂量响应曲线在30h的数据点做图,得到上层T细胞面积对SDF-1α浓度的对数值的曲线。
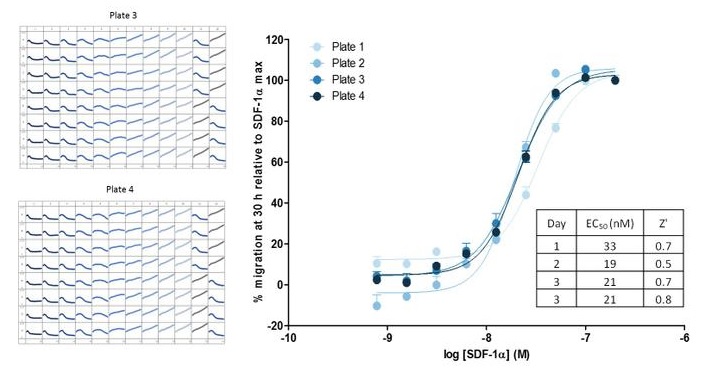
图33:96孔的趋化运动曲线显示极佳的板间重复性。三天内四块微孔板的Z’值为0.5-0.7,相应的对趋化因子SDF-1α的浓度响应曲线显示了对SDF-1α响应的重复性(EC50为19-33nM)。
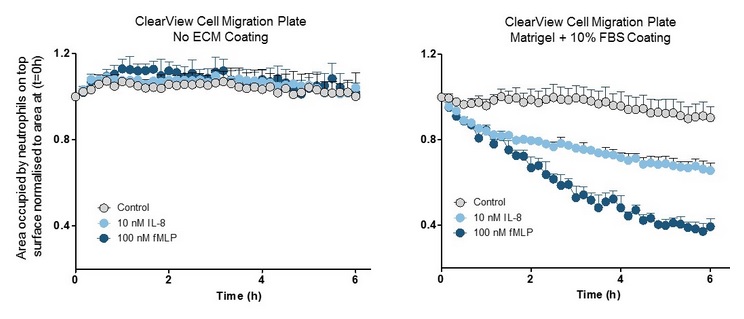
图34:检测“表面接触”介导的细胞迁移。ClearView的孔密度很低,细胞要向趋化因子方向运动就必须在膜表面进行迁移。左图:ClearView的膜未进行包被,细胞不发生迁移,此时趋化因子为:IL-8和fMLP。右图:膜表面被Matrigel包被,细胞有明显的趋化运动。该数据显示:整合素(integrin)和/或细胞表面受体与基质的相互作用是该模型中嗜中性粒细胞趋化运动的关键。相反,在Transwell中做嗜中性粒细胞的趋化实验时,则不需要进行包被(数据未显示)。
(十二)监测血管新生(Angiogenesis)
血管新生是一种复杂、多步的过程,包括内皮细胞增殖、内皮细胞迁移和血管形成。有两种冷冻96孔人共培养血管新生试剂盒供选择:1)CellPlayerAngiogenesis PrimeKit:将GFP标记的人脐带血管内皮细胞(human vascular endothelial cells,HUVECs)和正常的人真皮成纤维细胞(normal human dermal fibroblast,NHDFs)共培养,HUVEC细胞就会有血管样结构生成,然后用IncuCyte进行观察。IncuCyte ZOOM和CellPlayer Angiogenesis PrimeKit合用,能监测血管生成的全过程,同时测定药物对血管生成的作用。2)CellPlayer Angiogenesis StemKit:将用GFP标记的内皮克隆形成细胞(endothelial colony-formingcells,EDFC)和脂肪来源基质细胞(adipocyte derivedstromal cells,ADSC)共培养,EDFC就会有血管样结构生成,然后用IncuCyte进行观察。IncuCyte ZOOM和CellPlayer Angiogenesis StemKit合用,能监测血管生成的全过程,同时测定药物对血管生成的作用。
关键特性包括:1)ZOOM和血管新生软件相结合可自动获取时序性图像,显示血管新生过程中的所有阶段的变化;2)观察时间可长达2周,通过荧光定量GFP标记的内皮细胞;3)提供血管长度、血管面积和分支节点个数等动态指标,以计算EC50/IC50值;4)Z’>0.6,板间重复性佳,同时可做6块96孔板,得到576个数据;5)能测量促血管生成(pro-angiogenic)和抗血管生成(anti-angiogenic)的作用;6)动态读数可研究复杂的通路,包括VEGF(血管内皮生长因子)和non-VEGF(非血管内皮生长因子)信号介导的血管新生和血管分解;7)所有数据均有图像和影片进行验证;8)PrimeKit可展示血管新生的关键过程:增殖、迁移、分化和吻合;StemKit也能展示类似过程(pericyte like biology)。
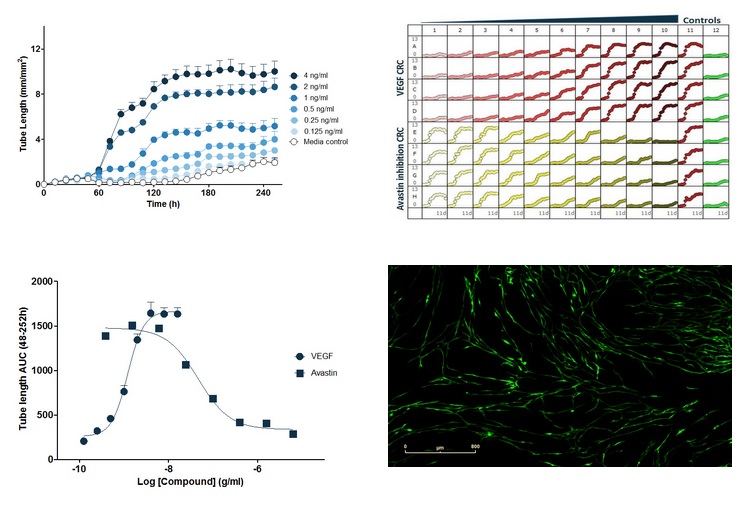
图35:在PrimeKit HUVEC和人皮肤成纤维细胞共培养模型中,由血管内皮生长因子(VEGF)诱导的基于浓度的血管形成。上左图:VEGF诱导的血管形成的时序图。上右图:96孔板图,VEGF在60h加入,横坐标为时间(h),纵坐标为血管长度(mm/mm2)。下左图:对时序数据的曲线下面积(AUC)进行分析,得到VEGF的浓度响应曲线(峰值血管长度);和阿伐斯汀(Avastin)对VEGF诱导(4ng/ml)血管形成的抑制的浓度响应曲线(峰值血管长度)。下右图:VEGF(4ng/ml)诱导的血管结构图像。
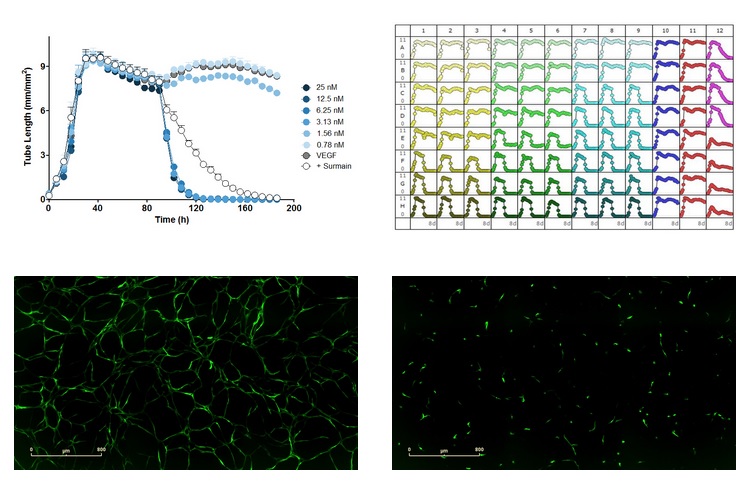
图36:在StemKit内皮克隆形成细胞和脂肪来源基质细胞的模型中,对已形成的VEGF诱导的血管进行基于浓度的分解。上左图:考布他汀(combretastatin)(96h加入)和苏拉明(suramin)(100µM,96h加入)对已形成的由VEGF(20ng/ml)诱导的血管的分解作用的时序图。上右图:96孔板图,VEGF分别于0h,96h加入,测试试剂于96h加入。横坐标为时间(h),纵坐标为血管长度(mm/mm2)。下左图:VEGF(20ng/ml)诱导的血管形成图像。下右图:加入微管分解试剂考布他汀(3nM)后的图像。
(十三)神经生长跟踪(Kinetic NeuroTrack)
IncuCyte ZOOM和NeuroTrack套件合用,可定量分析原代神经细胞和多能诱导干细胞来源(iPSC-derived)的神经细胞的神经突的生长状况,得到图像和生长曲线。
关键特性包括:1)可对神经细胞的动态生长(如神经突长度、分支节点、细胞簇)进行非标记的实时动态的定量分析,可消除耗费人力的昂贵的对神经细胞的免疫染色过程;2)自动的图像获取和整合的分析软件方便进行准确的神经突检测和数据分析;3),可同时得到高清晰相差图像和多通道荧光图像;4)用活细胞荧光标记研究神经元细胞和支持细胞(如星形胶质细胞astrocytes)共培养时神经突长度和分支节点个数;5)NeuroLight Red神经标记试剂可在神经元细胞中生成非扰动的红色荧光蛋白(mKate2)信号。6)与多种神经细胞类型相兼容(包括细胞系、原代细胞和干细胞来源的细胞);7)可进行多重实验,如和神经细胞毒性、神经细胞凋亡、神经细胞增殖和神经细胞迁移等实验一起进行。
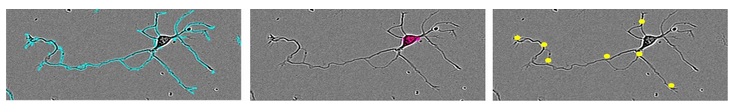
图37:NeuroTrack软件分析高清晰度相差图像。指标包括:总神经突长度(左图)、神经细胞簇数目(中图)和分支节点个数(右图)
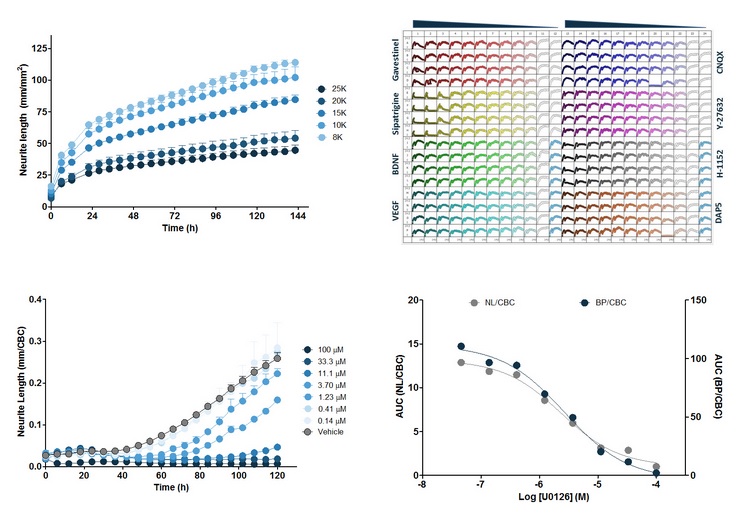
图38:上左图:iPSC来源的iCell神经细胞在不同接种密度下的96孔时序图。横坐标为时间(h),纵坐标为神经突长度(mm/mm2),每个数据点为6个孔的平均值。上右图:384孔板图,iCell神经细胞的神经突长度(mm/mm2)在8种不同化合物(48h加入)作用下的时序图,细胞在72h用IC80浓度的Kainic acid处理。下左图:Neuro-2A细胞用MEK抑制剂U0126处理的时序图。下右图:U0126对“神经突长度/细胞簇”和“分支节点个数/细胞簇”的浓度响应曲线。
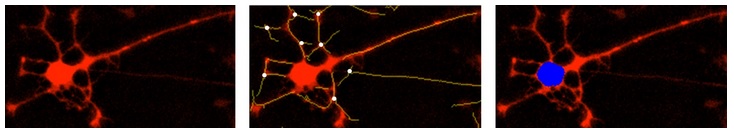
图39:NeuroTrack软件分析用NeuroLightRed慢病毒试剂转染的红色荧光图像。左图:红色荧光图像;中图:神经突的分割标记(黄色)和荧光图像的叠加,白色圆点为分支节点;右图:细胞簇的分割标记(蓝色)和荧光图像的叠加。
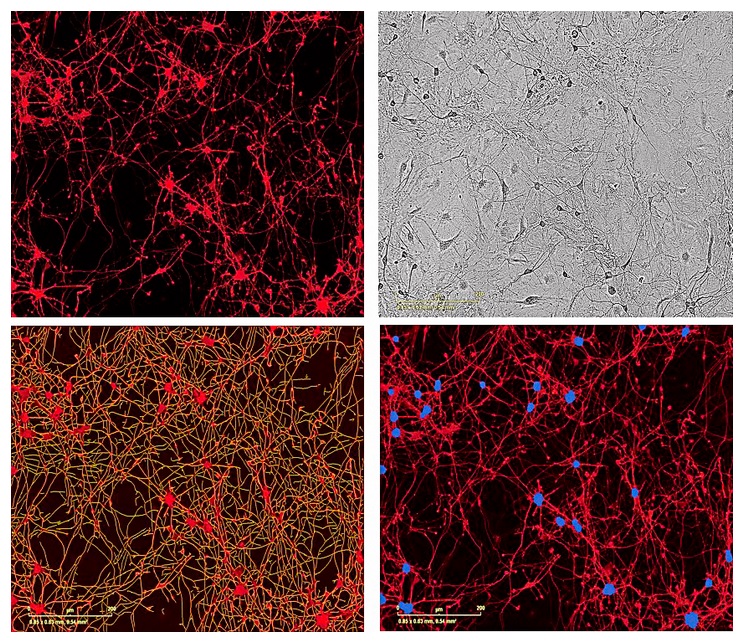
图40:用NeuroPrime Cell Kit和NeuroTrack软件套件测量原代鼠前脑神经细胞和鼠星形胶质细胞共培养时的神经突的生长。上左图:共培养的原代鼠前脑神经细胞用NeuroLight慢病毒试剂转染,接种7天后成像(20倍物镜)。上右图:对应的高清晰度相差图像。下左图:软件自动对神经突进行图像分割标记(黄色)。下右图:软件自动对细胞簇进行分割标记(蓝色)。

图41:用NeuroTrack分析和鼠星形胶质细胞共培养的原代鼠前脑神经细胞的神经突长度,神经细胞用NeuroLight Red标记,时间为12天。左图:对神经突长度的96孔板图。右图:实验的稳定性。图上的蓝色圆点表示13个微孔板的平均列的神经突长度(时间为288h)。实线表示平均神经突长度,虚线表示平均值的±20%。
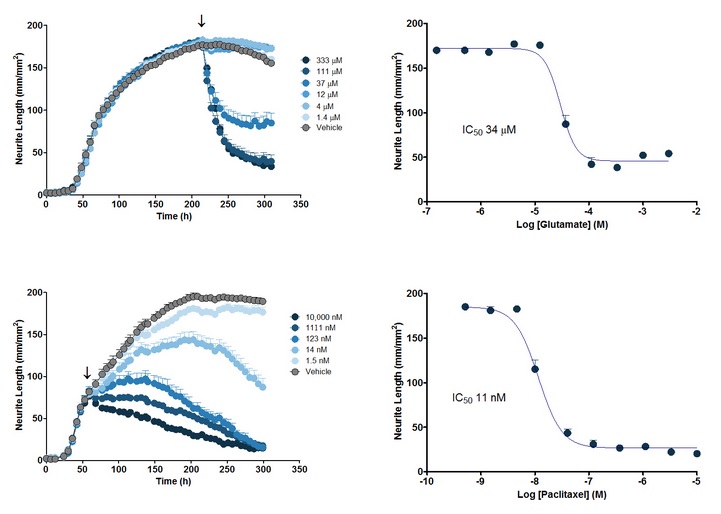
图42:用NeuroPrime Cell Kit和NeuroTrack软件套件测量神经突生长的定量药理学研究。上左图:在DIV9加入谷氨酸盐(glutamate)后神经突长度的浓度依赖性减小。上右图:从287h的数据得到的,神经突长度对谷氨酸盐的浓度响应曲线和IC50值。下左图:在DIV3加入紫杉醇(paclitaxel)后神经突长度的浓度依赖性变化。下右图:从263h的数据得到的,神经突长度对紫杉醇的浓度响应曲线和IC50值。
总结:
以上一些关键的重要的应用介绍,展示了IncuCyteZOOM 系统在定量的、非入侵性的、实时细胞分析上的作用。非标记、非损伤性的成像技术以及数据分析可以让用户获得高质量的图像、录像和数据。与其他利用电子阻抗监测细胞不同,IncuCyte可以记录细胞形态,得到图像和动态的录像。另外,Essen还开发出更多的活细胞实时动态观察试剂盒(live cell kinetic assays and reagents),与ZOOM配套使用,进行实验开发(assay development)、技术评估(technologyassessment)、外包服务(fee-for-service outsourcing)和药物开发合作(drug discovery partnerships)。
订购信息:IncuCyte ZOOM分HD和HD/2CLR两款,HD只能做相差成像,而HD/2CLR可以做相差和红/绿双色荧光成像,并且HD可以升级到HD/2CLR。套件包括:细胞迁移/侵袭套件(包括分析软件、96孔划痕器WoundMaker和15块96孔ImageLock微孔板)、神经跟踪套件(包括分析软件)、血管新生套件(包括分析软件)和趋化运动套件(包括分析软件)。
更多信息,请参考Essen网站:www.essenbioscience.com和典奥生物网站:www.tekontech.com
产品介绍链接:https://www.biodiscover.com/product/detail.html?id=259
大中华区总代理:上海典奥生物科技有限公司。联系方式(市场部刘经理):电话:(+86)21-58605185,传真:(+86)21-51973282,邮箱:marketing@tekon.net和sales@tekon.net。请关注微信公众号“典奥生物科技”:tekontech,获取更多信息!







