
近日,最新一期国际学术期刊cell stem cell刊登了来自澳大利亚哈德逊医学研究中心的Courtney McDonald教授题为"干细胞治疗在临床病例中的应用:进展与挑战"的综述性文章,就目前干细胞治疗方法在欧洲,加拿大,新西兰等国家的临床应用中所取得的研究进展进行了总结,同时也对干细胞疗法在未来发展中可能遇到的挑战进行了展望。
一直以来,干细胞治疗方法都被寄予厚望,科学家们期望能够利用干细胞疗法为遭受疾病和伤痛折磨的病人带来实质性获益,就像骨髓移植可以为病人重建造血系统和免疫系统,其它类型的干细胞移植也可以为疾病治疗带来显著效果,特别是胚胎干细胞(ESC)和多能诱导干细胞(iPSC),研究人员对这两类干细胞在多种疾病的治疗方面都持高度乐观态度。但干细胞治疗方法花费巨大,如果没有合理的评估和指导,相关研究很难长久维持。在这篇文章中,研究人员利用已经发表的临床治疗数据进行了总结和分析,数据主要来自于NIH和欧洲数据库,并根据干细胞类型和疾病应用进行了归类。
多能干细胞
在科学家们对ESC和iPSC的治疗潜能进行了大量研究和评估后,ESC和iPSC都在临床应用方面取得重要进展,在一些成体干细胞在获取途径,细胞扩增以及细胞收集等方面都存在许多障碍的领域,ESC和iPSC更加受到关注,其中在眼,胰腺和多种神经退行性紊乱损伤,如帕金森氏病,肌萎缩性脊髓侧索硬化和脊髓损伤的应用成为干细胞治疗方法开展的"先锋军"。
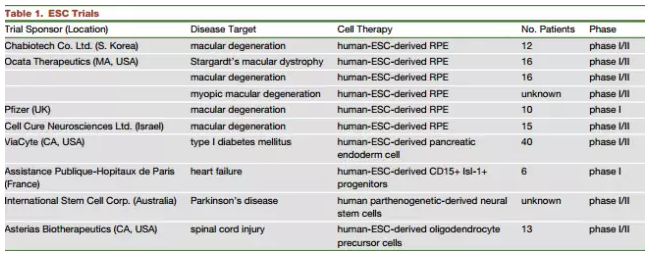
最早应用人类ESC进行疾病治疗的是Geron Inc. ,他们用ESC分化获得少突细胞祖细胞对5名脊髓损伤病人进行了治疗,在他们所使用的安全剂量下能够表现出一定的治疗效率,同时不会出现不良反应。但由于在进行人类临床试验之前需要对畸胎瘤形成的安全性进行验证以及利用动物模型进行治疗效率评估,导致这一项目的临床前研究花费非常巨大(约2亿美元),而临床研究阶段同样需要很多资金,最终该公司终止了这一干细胞治疗项目。目前这项研究由另外一家公司进行I期临床研究,在病人发生脊髓损伤后1-2周进行相同的干细胞治疗,该项目得到了美国FDA的批准。
另外,Ocata Therapeutics公司报告了关于使用ESC来源的视网膜色素上皮细胞治疗干性黄斑变性和Stargardt病的临床安全性问题的初步研究结果,他们选取了9名黄斑变性病人和9名Stargardt病人进行干细胞治疗。治疗后22个月内, 10只眼睛视力得到改善,7只眼睛视力得到稳定,只有1只眼睛视力发生下降,在72%的病人中观察到视网膜上皮再生,但这种再生性仍不太稳定也不能完全弥补视网膜上皮的缺陷,表明这种治疗方法仍需进一步的改进。目前英国和美国加州的研究机构也正在进行关于利用干细胞治疗黄斑变性的研究。
除此之外,美国加州的ViaCyte公司还利用ESC分化产生b胰岛祖细胞,将其制成胶囊植入I型糖尿病患者皮下,用以治疗因自身免疫导致的I型糖尿病,具体临床结果仍不得而知,但仍让人充满期待。来自澳大利亚的一个研究机构最近也发表声明打算利用ESC分化形成神经细胞用以治疗帕金森病,但科学家们关于这项研究的一个最大疑问在于ESC分化产生纯的A9多巴胺能神经元的分化效率到底如何以及是否会因5-羟色胺能神经元的污染而使病人发生运动障碍。缺少完善的治疗标准是否会导致干细胞疗法的临床研究进展受阻也是人们所关心的重要问题。
角膜缘干细胞
目前角膜缘干细胞移植已经成功应用于重建具有功能性的角膜上皮,而iPSC来源的角膜缘细胞谱系可能最终会成为使双目失明病人重见光明的角膜缘细胞来源。最近一些研究发现了调控角膜缘发育,分化和扩展的关键基因,这些发现可能对于加快角膜缘干细胞移植治疗相关眼部疾病具有重要推动作用。与此同时,体外培养的非眼部自体口腔黏膜上皮移植已经应用于治疗双侧角膜缘细胞缺陷,特别是受到化学物质急性烧伤的病人,应用这一方法可以克服之前口腔黏膜移植造成的血管化和角膜浑浊问题。
目前,从刚去世的遗体上获得的角膜缘组织通过"airlift culture"的方法可以在4_C 条件下保存完整结构长达8天,并可用于异基因个体移植,提供至少一个月的角膜上皮修复能力。这一结果表明异基因角膜缘干细胞治疗方法正稳步发展,但也有一些研究表明虽然利用这种方法可以使病人的病情获得一定改善,但在长期情况下这种获益会逐渐下降,应用这一方法进行临床治疗仍需进一步研究优化。
神经干细胞
神经干细胞来源的各类神经细胞已经应用于大量临床研究,这些应用主要集中在修复损伤的中枢神经系统上。用于中枢神经系统再生修复的最适神经元细胞类型仍不清楚,科学家们推断根据疾病和损伤类型不同,损伤修复所需的神经元细胞类型也存在很大差别。普遍认为神经元干细胞适于建立干细胞池稳定提供神经元,星形胶质细胞以及少突细胞,但成熟神经细胞可能对于特定细胞类型发挥正常功能也是非常必要的。
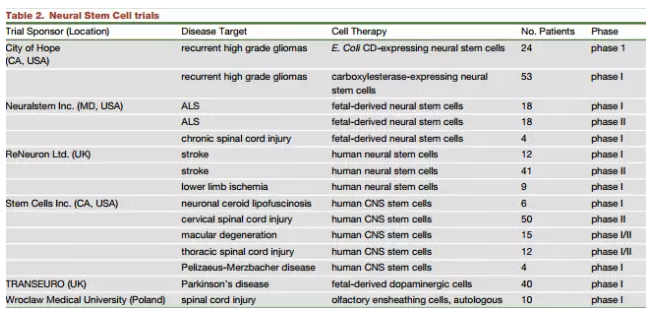
Stem Cell Inc.研究小组曾使用胎儿来源的神经元干细胞治疗儿童巴藤病(Batten`s disease),治疗后并没有出现明显的副作用。这家公司还对患有致命性遗传脱髓鞘也叫做PMD疾病的年轻病人进行治疗,科学家们将神经元祖细胞通过手术方法移植到4名患有严重早发性PMD的年轻病人的额叶白质内,随后进行观察发现有3名病人获得神经系统功能,并在手术移植位点附近出现髓鞘形成。这些研究表明通过神经干细胞移植或可以延缓严重遗传紊乱疾病的发展,以神经干细胞为载体导入合适的蛋白便可实现这一目标。
研究人员指出,在中风以及其他一些大脑和脊髓紊乱疾病的治疗方面可能存在更多挑战。尽管目前许多研究小组以实验动物为研究对象,使用多种类型细胞进行了大量研究,但仍没有证据表明干细胞及其分化细胞能够替代损伤细胞,重建神经回路或改善中风后神经元功能丧失。但ReNeuron公司在一项I期临床研究中,将永生化的人类胎儿神经元干细胞移植到11名中风病人体内,随后进行了12个月的跟踪观察,没有发现与细胞相关的以及与免疫相关的有害作用,这些永生化的神经干细胞不会强占脑组织,它们只是一群短暂存在的细胞群体,目前研究人员已经在这项研究中观察到一些病情改善,II期临床试验正在进行,旨在评估移植的神经元干细胞为中风病人带来的获益。
除此之外,作者还对神经元干细胞在肌萎缩性脊髓侧索硬化,脊随损伤,视网膜病变以及脑部胶质母细胞瘤的治疗应用进行了介绍总结。
内皮干细胞或祖细胞
NIH临床研究的网站列有大量关于内皮干细胞/祖细胞的案例,大部分处于"unknown"状态。标有"known"状态的12项研究都是自体移植,其中11例为临床I/II期,1例为临床II期。这些研究中所使用的细胞来自于骨髓或外周血。通过输血的方式将内皮祖细胞导入病人体内还可用以促进血管生成治疗顽固性心绞痛,在一项研究中,研究人员利用这种方法对19名病人进行了治疗,结果显示没有与细胞相关的有害作用,但治疗组病人心绞痛平均发病次数逐月下降。除此之外,科学家们还对内皮干细胞治疗严重肢体缺血进行了大量临床研究。目前在临床I/II期研究中发现,单纯使用骨髓MSC治疗顽固性心绞痛效果并不明显,是否需要内皮细胞进行联合治疗还需进一步研究。
内皮祖细胞移植所发挥的治疗作用是非常令人欣慰的,但仍需大量临床试验对内皮祖细胞在心血管修复方面发挥的作用进行验证。
胎盘干细胞
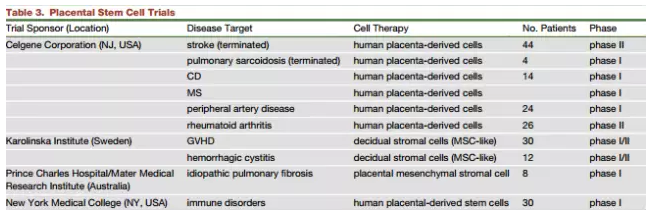
来源于人类胎盘的干细胞在临床应用方面也非常广泛。科学家发现一群胎盘MSC能够用于治疗特发性肺纤维化,除此之外,Celgene公司还利用MSC样细胞治疗克罗恩病和多发性硬化,结果表明克罗恩病的临床治疗效果差异性与使用的干细胞数量存在很大关联,而利用胎盘干细胞治疗对多发性硬化并没有产生明显的治疗效果,可能需要更多机制方面的探究。
此外,还有一些研究使用羊膜细胞对早产儿以及呼吸紊乱患者的肺功能进行提高,但这些细胞的应用仍存在很大障碍。
间充质干细胞
利用MSC进行的细胞治疗在许多临床案例中得到应用拓展。MSC细胞群存在很大异质性,其细胞来源也非常广泛。移植到宿主体内的MSC细胞存在时间非常短暂,在移植几天或一到两周之后就很难检测到,而应用MSC进行临床治疗的安全性问题也与MSC的这一特性有密切关系。
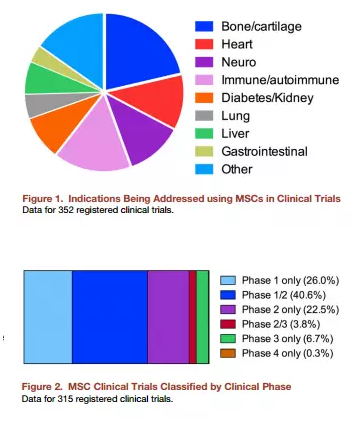
目前有大量关于MSC应用的临床研究正在进行,但大部分研究处在相同研究阶段,这可能表明利用MSC进行临床治疗发展比较缓慢,仍没有实际应用成果走出临床验证。其中一项IV期临床研究在中国进行的利用MSC治疗再生障碍性贫血,目前正处于病人招募阶段。临床研究中所使用的MSC细胞多为异基因细胞,并且这些临床研究分布在全世界,其中以美国,欧洲和中国进行的研究居多。
由于MSC具有多向性,在抗凋亡,血管生成,合成生长因子,保护神经元,抗纤维化以及驱化性等方面都能发挥作用,这也使得MSC在疾病治疗方面具有非常广泛的应用范围。
随后,作者从MSC的免疫抑制特性,心肌损伤修复,与骨关节炎及下腰痛,与肺部疾病,与肝脏疾病及糖尿病,与缺血性中风及ALS等方面对MSC的临床应用及研究进展进行了细致总结。
在文章最后,作者指出,目前多数干细胞临床研究还处于临床I/II期阶段,还在进行研究数据的收集,也有许多临床研究最终以失败告终,说明干细胞治疗的科学基础仍不牢固,还需要更多的基础研究工作来给予干细胞的临床治疗提供支持,但整体来看干细胞临床治疗的前景是非常光明的,也是非常鼓舞人心的,在下一个五年会有更多的干细胞治疗成果呈现在大家面前。






