
如果你曾经也有过骨折的经历,你应该知道这个恢复的过程是缓慢而痛苦的。
想象一下以后你无需长时间的手术,也不需要使用夹板就能让你从骨折/骨裂中恢复过来。相反,现在你遇到相同的状况时你的医生可能会对你说需要手术甚至是骨移植,即包含了从其他地方取骨,以填补你因为受伤造成的骨头缝隙。
这时你会面临一个选择:允许外科医生从你身上的另一个地方切一段骨头或者是从死者身上取出一段骨头。两者都是有风险的:从别人体内取出的骨头可能会携带疾病,所以医生必须要小心地甄别捐赠者。从你自己的身体内移植仍然会引起排斥反应,并引起疼痛、感染甚至是导致神经损伤。
Nina Tandon想去除这两个选项,取而代之的是,她希望可以帮助伤者的骨头自行进行生长。从你自己的细胞变成精确的形状和尺寸的骨头。
她的公司名为EpiBone,距离实现这一现实十分的接近。EpiBone利用干细胞和一种特殊类型的培养皿,生长出了耐用的活体骨头。
但前方的道路将是非常具有挑战性的。到目前为止,在实验室中生长的骨骼只有少量在动物体内中进行了测试,这种骨头对人体长期影响的一些全面性研究还有待完成。
“新组装”

很早以前,当时还只有7岁的Nina Tandon出于爱好拆开了她父母买的显像管电视,了解了每个零部件的作用并重新组装在了一起。
随着她成立了EpiBone,34岁的Nina Tandon的职业依然是把东西重新组装在一起,只不过这次不再是面对电极和电线,而是面对人的身体部位。
作为哥伦比亚大学生物医学工程专业的学生,Nina Tandon开始研究人体组织。在2013年,她用新生儿的心脏细胞和电刺激打造了一个5mm×5mm的能够跳动的工程心脏组织。现在她利用干细胞来构建针对个人的骨头。
原理
每年大约有90万美国人会接受与骨头相关的手术。对于有些人而言,因为他们经历了严重的创伤、骨癌或者是先天性缺陷,他们需要接受相关的手术,那么在EpiBone的治疗过程中,前期的手术和术后的恢复都发生了哪些重大变化。
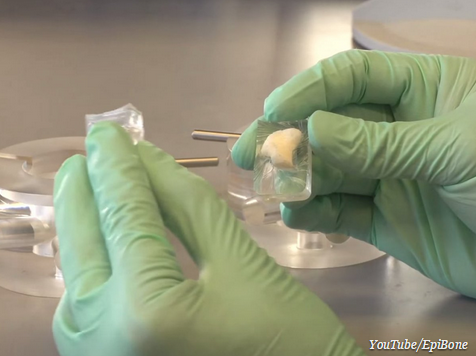
首先,Tandon和她的团队会对骨骼缺损进行CT扫描,以获得其确切大小和形状。然后,使用类似于吸脂的方法,他们从病人的脂肪中提取干细胞。EpiBone使用的细胞被称为多能干细胞,这意味着它们能够生长成许多不同的组织,包括骨头。
其中EpiBone的主要优势是,它的“材料”来自于人体自身的细胞,这意味着由它生长出来的骨头相比于外来的骨头或人造材料合成的骨头,被排斥的几率更加低。
一旦取得了病人的干细胞,EpiBone将会把干细胞放置在特殊的培养皿中或生物反应器中,在那里干细胞会沿着特定的框架进行生长。根据Tandon的说法,生物反应器中会提供给干细胞其所需的所有营养物质。该细胞发育至三到四周时,就可以对骨头进行定制了。
因为每个由EpiBone培养生长的骨头都能被定制的,它可以精确地被安置在所需的位置上,紧密贴合能帮助缩短手术和恢复时间。
挑战
约翰•霍普金斯大学的生物医学工程师Warren Grayson在实验室中一直从事于组织工程学的研究,他也是EpiBone的股东之一,在第一轮研究中,他证明了由干细胞生长得到的骨头,在移植至生物体内后可以正常“工作”。他的研究小组成功地把从脂肪组织中提取出来的干细胞培养成了人类颚骨。
第一个挑战是能否得到联邦政府的批准。虽然Tandon已经展示了她的产品在动物身上可以完美融合,但是她还没有在人体内进行测试。美国食品和药品管理局在批准药物之前通常需要多年漫长的审查,但是由于EpiBone是活体技术,想要获得联邦政府的同意,这个阻碍可能会更大。
其次是成本问题。因为每次EpiBone进行骨骼移植都必须根据患者自身的干细胞和伤势进行定制,它的成本可能会很昂贵。一项2012年的研究表明,实验室培养骨头的成本介于10,000到15000美元之间,成本大约是传统方式的三到四倍。
如何发展
Tandon的技术可以在未来的5-10年内在人体上实施,但是,从现在起直到那时,仍然有很多问题需要解决。
到目前为止,EpiBone尚未在人体中测试它的整个过程,但使用干细胞生长骨骼的技术已经在7例临床研究中被证明。由于大量技术与研究都是很早之前的成果了,所以对于科学家而言,以以往的研究成果,很难确定现有的技术也能达到同样或更好的水准。
大多数的研究规模都十分小,研究者并不能经常比较那些参与了他们研究的病人在接受传统手术或没有手术的情况下效果的差距。对于一些早期的研究,研究人员也无法保持与病人长期的沟通。
Tandon的团队计划是希望可以在18个月内在人类患者中首次测试她们的产品。在此期间,他们必须证明该技术是可行的。他们将在未来一年半的时间内做更多的测试,并尝试建立更大、更复杂的骨骼。






