2012年,日本科学家山中伸弥凭借其所发明的诱导多能干细胞技术(induced pluripotent stem cell,iPS)荣膺当年诺贝尔生理及医学奖。该技术通过诱导成熟体细胞某些特殊基因表达,将其逆转为具有各种发育潜能的干细胞,这个过程也被称作细胞重编程。iPS克服了胚胎干细胞带来的伦理问题,在细胞治疗和器官移植方面具有巨大的应用潜能,受到了人们的广泛关注。 在后生动物基因转录调控网络中,RNA Pol II是转录起始的一个关键步骤。本项研究中,研究者选择鼠胚胎成纤维细胞(mouse embryonic fibroblasts, MEFs)这种分化程度较高的细胞作为研究对象,试图通过比较体细胞、重编程过程中的细胞、胚胎干细胞(embryonic stem cells,ESCs)三类细胞中RNA Pol II在基因上的分布情况,了解细胞重编程过程中多能基因网络调控机制。通过分析已有的GRO-Seq(Global Run-On Sequencing)数据,研究者发现,在ESCs中,Pol II在近启动子区域“暂停”状态比MEFs要多,并认为在ESCs中,多能性基因的转录调控与MEFs有所不同。通过对OSKM(OCT4、SOX2、KLF4、和c-MYC)重编程处理后的MEFs进行ChIP-Seq检测,研究者发现,随着重编程时间延长,RNA Pol II会越来越多地暂停在近启动子区域,阻止一些关键多能性基因的表达,进一步阻碍重编程过程。
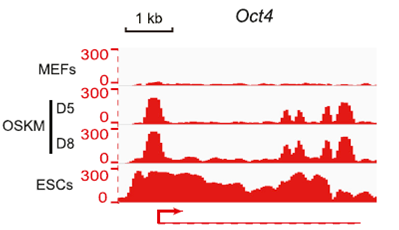
MEFs重编程过程中Oct4基因RNA Pol II结合情况
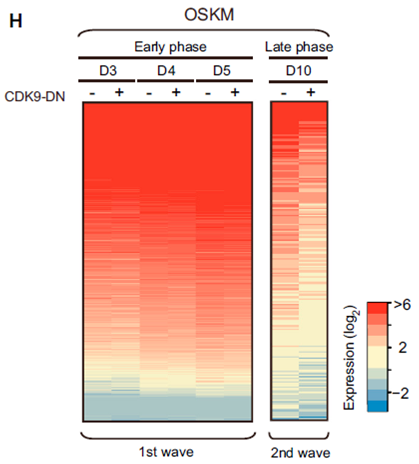
突变CDK9后对重编程MEFs进行RNA-Seq结果
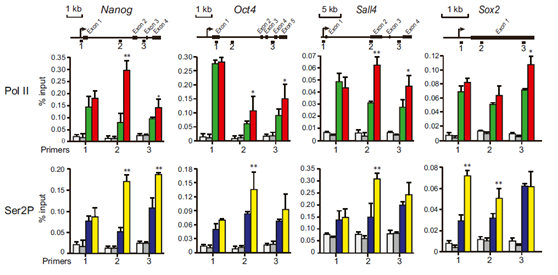
BRD-CTD处理后四个基因上PolII及Pol II Ser2P的ChIP-qPCR结果,结果显示,BRD-CTD增强了PolII在基因主体上的结合。

Nanog基因上CDK9/KLF4的ChIP-Seq结果
之前已有研究表明,P-TEFb复合体会通过其催化亚基CDK9,磷酸化RNA Pol II,比较ESCs和MEFs,研究发现ESCs中CDK9表达量更高,RNA-Seq数据表明,如果在MEFs中沉默CDK9,会明显下调多能性基因表 达,包括其著名靶基因Hexim1。在很多细胞中,CDK9都会与HEXIM1组成复合物,保持失活状态,由于另一个蛋白BRD4会通过去除HEXIM1 激活CDK9,研究者进一步探索了MEFs重编程过程中BRD4和HEXIM1的角色,通过构建靶向BRD4的shRNA、过表达载体及不同的BRD4及 CDK9突变体,利用ChIP-Seq实验,研究者发现,BRD4会增强RNA Pol II的Ser2P修饰水平,强烈结合于多能性基因启动子区域,诱导多能性基因表达。这些结果证实,BRD4的确可以代替HEXIM1与CDK9互作,激活 CDK9,促进多能性基因的表达,是重编程的一个正向调节因子,而HEXIM1则会发挥与BRD4相反的作用,它会阻止多能性基因表达,是重编程过程的一 个障碍。
由于CDK9需要转录因子帮助才能在特定位置结合,修饰RNA Pol II,为了鉴定MEFs中介导CDK9富集的转录因子,研究者将OSKM四个重编程因子转入HEK293T细胞内,通过免疫共沉淀及ChIP-Seq数据分析,证实KLF4会与CDK9共同结合于多能性基因启动子区,对RNA Pol II进行修饰,改变其暂停状态,诱导多能性基因开始转录。
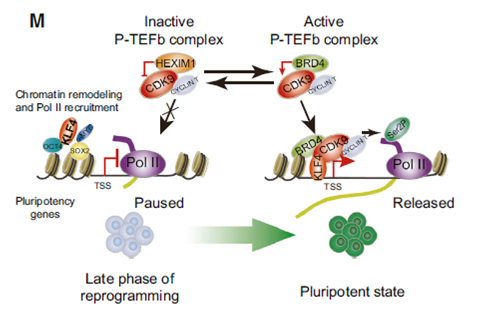
调控通路示意图
至此,研究者确认了细胞重编程过程中一条完整的调控通路,在该通路中,不同调控因子相互作用,通过RNA Pol II的磷酸化水平,促使其在多能性基因启动子区域由“暂停”状态进入“延伸”状态,诱导这些基因转录。对此通路的研究,有助于人们更好地理解细胞命运如何 发生变化,显著提高体细胞重编程的效率,同时也对诱导多能干细胞在治疗重大疾病如帕金森、心血管疾病等方面的应用研究具有重要意义。
相关文献:Liu L, Xu Y, He M, et al. Transcriptional Pause Release Is a Rate-Limiting Step for Somatic Cell Reprogramming[J]. Cell Stem Cell, 2014.







