肝脏疾病已成为越来越重的负担,仅在英国,去年一年由其导致的死亡人数已达 10000。肝功能不全指急性或慢性肝病导致肝脏正常生理功能的改变,肝细胞不能有效增生而出现功能障碍。未经治疗的肝功能不全最终危害患者生命,目前核心的有效治疗在于全肝移植。
随着肝病负担的加重,越来越多的患者需行肝移植治疗,远远超过适合的肝脏供给数目,许多不能进行肝移植治疗的患者过早走向了生命尽头。来自英国国王学院的 Tamir Rashid 等就细胞治疗肝病的进展进行综述,并发表在 2014 年 9 月 2 日的 Gut 杂志上。
肝细胞治疗
肝脏由多种细胞构成,如内皮细胞、星状细胞、胆管上皮细胞、Kuppfer 细胞及自然杀伤细胞等,它们共同构成了肝脏主要细胞——肝细胞周围的支持结构,用肝细胞治疗肝病从理论上来说似乎是肝移植的有效替代方案。
在小动物身上的多种肝病模型显示,肝内肝细胞移植是有效的,然而人体试验却不太令人满意,最好的研究结果(也可能是仅出现的)出现在代谢性肝病的患儿身上。这点提示,这些间质细胞在肝细胞移植中也有着十分重要的作用。
然而构建肝脏间质细胞的工作十分繁琐,临床上更加可行的一种方案或许是肝外肝细胞移植(E-HTx),在肝功能不全患者等待移植过程中或自身修复功能恢复时起过渡作用。初步的临床研究表明,将藻酸盐颗粒包裹的肝细胞运送至急性肝衰竭的患儿腹膜周围有一定作用。
这些研究都很振奋人心,但仍需进一步确认。扩展这一技术应用的重点在于弄清楚 E-HTx 有效是因为移植的细胞是作为独立的肝外器官起作用,还是间接(移植的细胞通过分泌某些因子从而增强自身肝细胞的增生功能)起作用,探明这点才能更加准确评估获益更大的患者。
干细胞为基础治疗的前景
许多肝病专家认为,肝内与肝外肝细胞移植均存在潜力,但受肝细胞供体不足的限制。增加肝细胞来源途径,如从干细胞中获取肝细胞等方式将有助于解决此问题。但关键问题在于:怎样获得这些细胞及如何知道所得细胞就是肝细胞?
尽管干细胞被认为存在于任何组织中,但其在成人肝组织内的存在与否却备受争议。至今为止,还没有人能从肝脏干细胞中分离出能独立增殖、发挥临床作用的干细胞。
另一方面,胚胎干细胞(ESCs)的存在毋庸置疑,它们来源于胚胎的内细胞团,能再次种植并最终执行特定功能。ESCs 具有多能性,也就是说,它们分化能力很强,并且能分化成人体内的任何一种细胞类型,这与组织中的肝细胞不同,因为后者的分化及分裂能力都存在一定限制。
然而 ESCs 的获得受其来源及伦理限制,因而在临床中应用不广。2006 年,一个令人兴奋的发现指出了可能取代 ESCs 作用的方法。日本的一位干细胞生物学家 Shinya Yamanka 发现了另一种多能干细胞,它并不来源于 ESCs,而来源于成人细胞,并将其称为诱导多能干细胞(iPSC)。
这种细胞可以从成人身上的任何一种细胞中获得,但通常从皮肤成纤维细胞中获得,因其获取方式容易。制取 iPSC 的方法简单,需要几个重要转录因子的短暂过度表达,通过重新编码、表观修饰,首发细胞回到胚胎干细胞状态。
由于该细胞增生能力极强,如果能发现诱导 iPSCs 转化为肝细胞的合适制剂,将有源源不断的肝细胞产生。该方案除了能解决肝细胞来源问题,也有助于解除患者免疫抑制剂使用需要。重新编码能使细胞恢复再生能力这一理论已在多个实验室中得到证实,为其在临床应用中的可行性进一步提供了依据。
干细胞——经重新编码并转化为肝细胞(R-HEPS)
将供体细胞重新编码转化为多能干细胞现在已十分容易实现,然而,使其转化为肝细胞却极具挑战。许多研究团队正在使用体外培养二维细胞方法的基础上,不断尝试和重复,以期发现干细胞转化为肝细胞的方法。
紧随而来的是另一波学者,他们报道了一种使干细胞转化为肝细胞或内胚层细胞更直接的方法,后者速度更快,但仍需更多研究重复。有趣的是,有报道称,第二种方式所产生的细胞的某些表型特征优于第一种方式。
肝细胞质量
假设通过重新编码技术来获得肝细胞前景乐观,我们可以想象不久后将有数以亿计的肝细胞运用于临床,迎接我们的下一个挑战是设定质量控制措施,即如何知道从生产线上获得的细胞就是我们需要的。
尽管原代肝细胞的几个重要特征在重新编码获得的肝细胞(r-Heps)中都具备,仍然有对其成熟度和安全性的顾虑。研究人员似乎同意 r-Heps 在某些方面仍不成熟——本质是相符的,但是可能在完全分化成熟方面遇到障碍,因此需要进一步研究。
许多科学家现在集中精力尝试体外生产成熟肝细胞,并小有成就。目前公认的推断一种细胞是否成熟主要基于两点:体外药物代谢和体内观察鼠类肝损伤模型的修复能力。原代肝细胞是采用 50 多年前发明的一项技术从人肝脏组织中提取出来的。
此外,更重要的是弄清楚哪种肝细胞会在某种特定的肝病中其治疗作用。因此,我们需要扩大动物试验的规模或者大力推进人体试验。虽然继续研究和改进细胞生产将为人类带来益处,但 Tamir 等建议是时候检测已获得细胞在人体内的有效性。然而,我们必须时刻谨记,这些细胞的遗传及表观遗传稳定性尚未明确。
因此,在人体内使用重新编码细胞十分危险,因为他们在体内的分布并不能控制。因此,Tamir 等建议发明一种可移动的载体将细胞装载,避免其在体内播散或形成肿瘤。这也让我们考虑,此结构的多维、多细胞构成是否会影响其功能发挥,以及下一代的肝细胞疗法是否也会遇见类似的问题。
多维肝细胞
正如上面所讨论的,现行的关于肝细胞转化的方案聚焦在单细胞的分化,很有可能产生多种细胞,使其功能不能发挥极致。我们忽略的一个重要事件是细胞之间的信号传导,该过程在时空上对器官发育进行调节。
空间的调节在三维状态下发生,与支撑结构如间质细胞和血管细胞的相互作用有关。细胞间相互作用精确的时间调控在三维调控的基础上更添难度。这些都显示肝脏自然生成的过程中需要四维、多细胞的调控。目前的干细胞培养系统尚难以达到四维调控的目的。
为了应对这一挑战,科学家们又研发出一项新技术,通过对早期器官形成的细胞间的相互作用进行调控而培育出“器官芽”。特异的由 iPSC 获得的肝细胞与间质祖细胞及内皮祖细胞共同培养,可以缩合形成三维的类器官结构。多种祖细胞产生的作用对其进行四维调控,从而形成了肝芽样结构(微型肝)。
令人兴奋的是,将肝芽样结构移植入体内,血管生成将刺激肝细胞成熟,此过程无需其他环境诱因(如严重肝脏损伤)。成熟的肝脏结构能显著改善化学药物诱导的肝衰竭小鼠的预后。通过 iPSC 获得的肝芽似乎能够作为肝外来源的肝脏支持系统提供潜在的治疗作用。
尽管仍存在不明问题,如起治疗作用的直接或间接原因。但该技术最终有望治疗肝功能不全。同时,它也为一个假说奠定了基础,即为了获得最有效的治疗结果,重要细胞之间复杂的生物学相互作用可能需要重建。
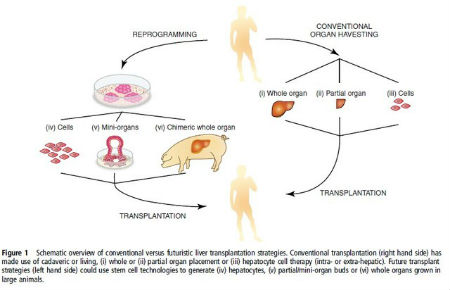
肝细胞——一个完整器官
尽管单细胞、多细胞、芽细胞等治疗方案将对数目众多的肝病患者产生重大影响,但它大多数情况下无法治疗需要全肝移植的患者。为了应对这一挑战,我们必须明白干细胞生物学的“圣杯”——在实验室中合成一个全新的器官。
近期一些研究表明,实验室中使用工程支架“播种”干细胞而获得产物能带来较好的经济效益,但以相同的规模及根据人类的复杂度重复该过程目前仍困难重重,即便是前面提到的体外获得有功能的肝细胞也不是一项能轻而易举就完成的挑战。
比较折中的是采用杂交途径,即使用大型动物作为活的载体支架,使通过 iPSC 获得的肝细胞完成转换,因为大型动物肝脏及胰腺等器官的生理机制与人类相似。为了达到这一目的,我们必须设法将 iPSCs/ 肝芽种植到适合的动物宿主,并使其停留足够长的时间以使四维器官生成。
沿着这条路径,近来有研究报道,由基因工程造成的器官缺陷动物,在其植入前胚胎阶段,补偿性地提供供体干细胞,能产生有功能的胰腺,该结论已在鼠类和猪体内得到证实。有一点仍不明确,即从高等动物如灵长类及人类身上获得的供体细胞是否也能同样完成组织重建。
如果上述跨种族的杂交能够成功,我们将有望从猪和羊身上获得成千上万的人类肝脏。确实,如果上述方案可行,我们可以把那些动物称为“器官生物反应器”,因其解决了我们供体器官短缺的问题。
可能就目前来说,该想法超越了科学现实,但是尽管其不能即刻获得可以使用的终产物,这项技术无疑证实了在实验室中获得有功能的干细胞源性治疗方案是有效的。