最近,美国Salk研究所的研究人员通过仔细控制两种蛋白的水平,发现了如何在实验室中保持乳腺干细胞(可形成乳腺组织)存活和细胞功能。这种繁殖乳腺干细胞的新能力,可使我们能够研究乳腺的发育和乳腺癌的形成。
Salk研究所Clayton肽生物学基础实验室的科学家Peter C. Gray称:“研究结果表明,我们能够从小鼠中取出这些细胞,在实验室中研究它们,并通过给它们提供一种特定因素来调控它们。”他与该研究所Geoffrey M. Wahl教授实验室的高级研究助理Benjamin T. Spike合作完成了这项研究。相关研究结果最近发表在Cell期刊旗下《Stem Cell Reports》杂志。
乳腺干细胞可在胎儿发育期、青春期或哺乳期,产生新的乳腺细胞,可能也在乳腺癌中发挥作用,所以对于乳腺癌研究来说,它们是一种非常有前景的途径。但是,一直以来,我们都很难分离这些干细胞并在实验室中维持它们。
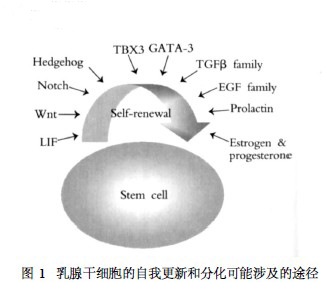
Salk研究所Clayton肽生物学基础实验室的科Spike称:“以前有很多研究表明存在乳腺特异性干细胞,但是几乎不可能从成人身上大量地分离它们。然而我们以前发现,我们可以转向早期发育阶段,此时的干细胞比例更高。”当研究人员利用胎儿的乳腺组织而不是小鼠成体组织时,他们能够明确哪些细胞是干细胞,但是在实验室中培养这些细胞时,它们的变化快速。所有干细胞的一个典型特性就是,当它们分成两种新细胞时,它们就能形成干细胞和分化细胞(将要变成一种特定类型组织的细胞)。
Spike和Gray在培养皿中培养乳腺干细胞,并对其进行染色,使新的干细胞与分化的乳腺细胞表现不同的颜色。然后,他们就开始检测两种蛋白质(被称为CRIPTO和GRP78)的效应,这两种蛋白质在干细胞生物学和胚胎发育过程中起着重要的作用。分离的胎儿乳腺细胞显示高水平的CRIPTO(绿色)和GRP78(红色),已有研究发现它们可有助于控制乳腺干细胞的分化。
研究人员指出:“在正常情况下,我们首先看到细胞为黄色——在一个细胞中红色和绿色的组合,然后看到红色或绿色细胞,说明我们的细胞能够产生两种不同类型的成熟细胞。但是当我们再做一次实验,并开始改变蛋白质的水平时,这些细胞的比例变得非常不同。”研究人员发现,当他们阻断CRIPTO后,细胞主要形成分化细胞,而不是新的干细胞。随着时间的推移,这种干细胞群体萎缩,因为它们不能重新再生。
当他们改为提高CRIPTO的水平时,产生的干细胞群体(生长为新的干细胞)比分化的细胞更多。在小鼠研究中,科学家们还发现,CRIPTO可帮助动物形成新的乳腺组织,这使研究小组推测,CRIPTO可能是由附近的脂肪细胞产生,来刺激乳腺组织的生长。在以往的研究中,Gray的研究小组发现,GRP78可与细胞表面的CRIPTO蛋白结合,并调控CRIPTO的功能。这促使科学家们检验GRP78是否对乳腺干细胞有影响。正如他们所怀疑的,当细胞其表面缺乏GRP78时,它们就不能响应CRIPTO。
CRIPTO和GRP78都与癌症有关,包括乳腺癌和肺癌。科学家认为,一种高水平的蛋白质可以利用它们刺激乳腺组织生长的相似通路,促进肿瘤的生长。有了分离和维持乳腺干细胞的这种新能力之后,Spike和Gray希望他们能够发现,CRIPTO和GRP78到底激活了什么细胞程序。
了解这些可让我们进一步理解这些蛋白质如何参与了肿瘤的生长。此外,研究人员认为,靶定CRIPTO和GRP78——是理想的药物靶点,因为它们存在于细胞外部——可阻止或减缓肿瘤的生长。Gray称:“我们认为,靶定CRIPTO和GRP78,可能是补充现有治疗方式的一种独特方法,而现有的治疗方法是通过靶定癌症中的干细胞样细胞。”






