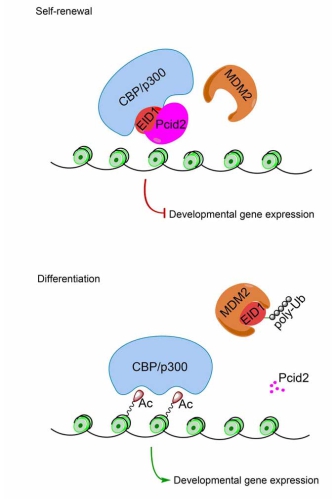
近日,干细胞研究权威期刊Stem Cells杂志在线发表了中科院生物物理研究所范祖森课题组题为“Pcid2 Inactivates Developmental Genes in Human and Mouse Embryonic Stem Cells to Sustain Their Pluripotency by Modulation of EID1 Stability.”的研究论文,揭示了Pcid2蛋白调控胚胎干细胞(ES细胞)多能性维持的分子机制。
ES细胞自我更新由全能性相关基因的表达和分化相关基因的关闭实现,而ES细胞的分化则对应着特异转录因子的激活,谱系特异基因的上调表达及全能性基因的表达抑制。对胚胎干细胞自我更新与分化的命运转换调控机制目前阐释的并不清楚。已有的研究表明表观遗传机制在胚胎发育及干细胞分化等生理过程中发挥重要的调控作用。其中,CBP/p300蛋白复合体作为组蛋白乙酰转移酶及转录共激活因子,在胚胎发育、转录调控及胚胎干细胞分化中发挥关键作用。Pcid2是酵母中调控mRNA出核转运相关复合体中Thp1的同源蛋白,Thp1参与mRNA的转运调控。通过全基因组RNAi筛选,表明Pcid2在小鼠ES细胞干性维持中发挥作用,然而,其作用机制尚未阐述。