美国食品药品管理局(FDA)的一个顾问小组认为,使用药物设备组合Melblez Kit直接将美法仑(左旋溶肉瘤素)输送到肝转移性葡萄膜恶性黑色素瘤患者的肝脏内,其风险超过任何可能的治疗收益,顾问小以16比0的投票结果拒绝批准该药物设备。
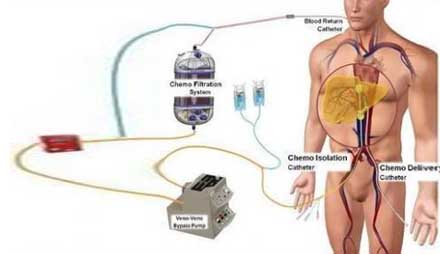
Melblez Kit是美法仑与Delcath肝脏输送系统组成的一种药物设备,其中肝脏输送系统由两根医用导管和一个体外血液滤过组件组成。根据生产厂家Delcath Systems提供的信息,医用导管用于将高剂量化疗药物经肝动脉直接输送入肝脏,而体外血液滤过组件在血液返回体循环之前降低血液中的药物浓度。
进行此项程序需要患者住院大约4天的时间,整个操作过程需要全身麻醉,大约花费3小时,并且两次操作要间隔4周的时间。
在疗效方面,尽管治疗组患者的肝脏无进展生存期和总体无进展生存期取得了显著进步,达到了临床试验的目标。但FDA显然不满足,因为总生存期并未纳入疗效目标。治疗组的中位总生存期为9.97月,而对照组为9.95月,两者没有显著差异。
事实上,一个产品遭到专家组安全性否决后,FDA的拒绝几乎是板上钉钉的事情。在提出更换过滤器未果后,Delcath公司有预感地开始了危机举措,包括裁员及解雇CEO。Melblez的未来则变成了未知数。
在目前,没有任何手段可以对付不能手术切除的肝转移性黑色素瘤,Melblez的设想十分具有前景。如果获批,其前途或许一片风光。但作为首提概念的NDA产品,面对未知的棘手问题太多,它的研发之路注定是一片坎坷。
1989年,Melblez开始临床。
2008年,被授予孤儿药地位。
2011年,初次申请被FDA拒绝,理由是数据不全。公司随后再次提交了申请。
2013年4月,专家组全票否决。公司提出更换过滤器未果。
2013年9月13日,FDA全盘审议文件后否决。
FDA在回复函中指出,Melblez的主要问题是药物泄露至血液中,从而导致严重的毒性反应。Delcath公司曾解释,更换体外过滤器可以解决这一问题。但这一解释并未为FDA所接收,它建议,应对此进行一项全新的随机试验,同时将总生存期纳入疗效目标。
但新的试验意味着费钱又费力。在经历了连续挫折之后,Delcath公司是否还存在信心,则不可而知。
Melblez设备于2011年2月获得了CE认证。







