日前,来自华盛顿大学医学院等机构的科学家们通过报道从胚胎干细胞到最终分化细胞这一细胞进程中,DNAseI 超敏感位点的作用模型,解析了 DNA 表观遗传对于发育命运和细胞成熟调控的作用。这将揭示细胞表观调控机制,以及癌症细胞的发育机制。相关研究论文刊登在了近期出版的《细胞》(Cell)杂志上。
领导这一研究的是美国华盛顿大学医学院和基因组科学中心 John A. Stamatoyannopoulos 博士,这位学者同时也领导美国国立健康研究院(NIH)下属的四个表观遗传学研究中心之一的西北注释表观基因组绘图中心,是 ENCODE 计划及表观基因组路线图(ROADMAP EPIGENOMIC)等重大项目的主要负责人之一。
随着研究的深入,科学家发现 DNA 序列不是唯一的遗传信息,除了基因组 DNA 外,还有大量遗传学信息调控着基因的表达,称之为表观遗传信息。
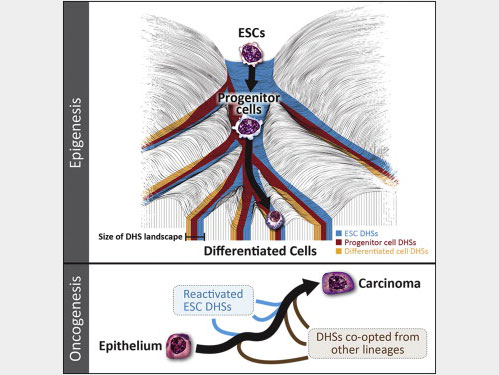
近年来的研究指出,几代发育细胞之间的细胞状态信息,可能可以通过调控区域被传递下来。在这篇文章中,研究人员报道了从胚胎干细胞到最终分化细胞这一细胞进程中, DNAseI 超敏感位点( DNAseI hypersensitive site, DHS)获得和失去的一致模型,这将有助于解析细胞表观遗传作用,并揭示调控 DNA 中的变化对细胞命运的影响。
这一 DHS 模式传递了关于细胞命运的丰富信息,其中的关联与基因表达传递的信息并不相同。研究人员发现发育细胞具有与胚胎干细胞一部分相同的DHS分布,这一比例在不同的细胞类型中,随着分化过程不断下降,这表明发育成熟存在一种定量的基准。
而且研究人员也指出,发育稳定DHSs能不断编码转录因子结合位点,参与自动调控反馈环路。而与正常细胞不同,癌细胞则会广泛激活沉默了的胚胎干细胞 DHSs,促进恶性肿瘤产生。
这一研究结果揭示出了,调控 DNA 中的变化能作为细胞命运转换,谱系发展的量化指标,这将有助于揭示细胞表观调控机制,以及癌症细胞的发育机制。
Stamatoyannopoulos 博士实验室主要通过分子与计算生物学技术分析绘制真核生物调控基因组学与表观遗传组学图谱。其实验室当前主要从事的重要研究方向是描绘人类与模式动物小鼠整个顺式调控元件全貌,并预测其与疾病相关的非编码序列变异相关的生物学功能,研究水平居于世界前列。
而近年来,Stamatoyannopoulos 博士及其实验室与中科院北京基因组研究所方向东课题组合作开展 “干细胞血液分化的表观遗传学机制研究”课题,并联合培养了 1 名生物信息学博士后。







